
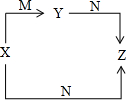
 X.Y、Z、M、N五种物质中,X、Y、Z中均含有钠元素,X和M都是常见的单质,N是水,它们之间具有如图所示的转化关系.下列有关物质的推断不正确的是( )
X.Y、Z、M、N五种物质中,X、Y、Z中均含有钠元素,X和M都是常见的单质,N是水,它们之间具有如图所示的转化关系.下列有关物质的推断不正确的是( )| A. | X只是钠 | B. | Y只是Na2O | C. | Z只是NaOH | D. | M可能是O2 |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | MgO的熔点很高,可用于制作耐高温材料 | |
| D. | 光导纤维属于硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为电池的正极 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 该电池放电过程中电解质溶液浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时C的转化率:乙>甲 | B. | 平衡时C的物质的量甲<乙 | ||
| C. | 平均反应速度:乙>甲 | D. | 平衡时A的物质的量甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,加快了反应速率,反应的△H也之改变 | |
| B. | 改变压强,反应速率发生改变,但平衡不发生移动,反应放出的热量不变 | |
| C. | 温度降低,正、逆反应速率都减小,反应放出的热量不变 | |
| D. | 恒容时充入稀有气体或充入H2,正、逆反应速率都减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com