
下列离子中,核外有10个电子的是
A. Mg2+ B. S2- C. K+ D. Cl-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


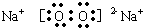
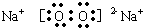
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
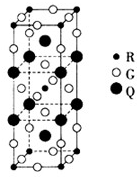 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省清远市英德市中学高三(上)第二次月考化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com