
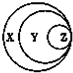
 如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )| 选项 | X | Y | Z |
| A | 混合物 | 溶液 | 胶体 |
| B | 酸 | 强酸 | 硫酸 |
| C | 纯净物 | 无机物 | 甲烷 |
| D | 化合物 | 碱性氧化物 | 酸性氧化物 |
| A、A | B、B | C、C | D、D |
科目:高中化学 来源: 题型:
| A、对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变 |
| B、同温同压下,H2(g)+Cl2═2HCl(g)在光照和点燃条件下的焓变不同 |
| C、甲烷的标准燃烧热为-890.3KJ?mol-1,则甲烷的燃烧热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ?mol-1 |
| D、500℃,30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3气体,放热19.3KJ,其热化学方程式为:N2(g)+3H2?2NH3(g)△H=-38.6KJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低 |
| B、由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高 |
| C、由石墨制备金刚石是放热反应;石墨的能量比金刚石的低 |
| D、由石墨制备金刚石是放热反应;石墨的能量比金刚石的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
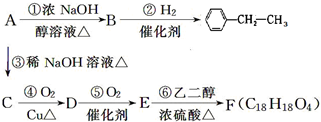
 大36.5,请回答:
大36.5,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
| KMnO4酸性溶液 的浓度/mol?L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
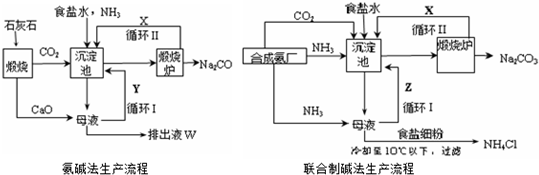
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com