
| A. | C2H6O | B. | C3H8O | C. | C3H6BrCl | D. | C4H9Cl |
分析 A、C2H6O属于醇或醚,据此进行解答;
B、C3H8O属于醇或醚,据此进行解答;
C、C3H6ClBr可以可知丙烷中的2个H原子分别为1个Cl、1个Br原子取代,丙烷只有一种结构,氯原子与溴原子可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子,据此书写判断;
D、依据丁基有4种进行类比解答即可.
解答 解:A、C2H6O是乙醇或甲醚,有2种同分异构体;
B、C3H8O是1-丙醇或2-丙醇或甲乙醚,有3种同分异构体;
C、C3H6ClBr可以可知丙烷中的2个H原子分别为1个Cl、1个Br原子取代,丙烷只有一种结构,氯原子与溴原子取代同一碳原子上的H原子,有CH3CH2CHBrCl、CH3CBrClCH32种,可以取代不同碳原子上的H原子,有BrCH2CH2CH2Cl、CH3CHBrCH2Cl、CH3CHClCH2Br3种,故共有5种;
D、丁烷有2种同分异构体CH3CH2CH2CH3、(CH3)2CHCH3分别有2种、2种氢原子,所以丁烷共能形成4种丁烷基,所以一氯戊烷的同分异构体有4种;故最多的是C,故选C.
点评 本题考查同分异构体的书写,难度中等,注意类别异构这一知识点,此外一元取代同分异构体利用等效氢进行的判断是关键.


科目:高中化学 来源: 题型:解答题
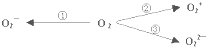 据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
据2004年1月17日网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,是一种高能量分子.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠和钾的合金具有导电性,可用于中子反应堆热交换剂 | |
| B. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 水玻璃易溶于水,可用于生产黏合剂和防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯的一般通式是RCOOR′和R′可以相同,也可以不同 | |
| B. | RCOOR′和R′可以是脂肪烃基,也可以是芳香烃基 | |
| C. | 在RCOOR′中,当R和R′均为-CH3时,这种酯叫甲酸甲酯 | |
| D. | 碳原子数相同的饱和一元羧酸和饱和一元酯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 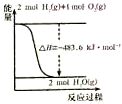 由图可知:H2的燃烧热为241.8kJ•mol-1 | |
| B. | 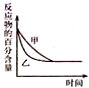 图中表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强比甲的压强大 | |
| C. | 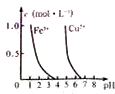 如图,若除去CuSO4溶液中的Fe2+,可向溶液中加入适量CuO,调节pH=4,过滤 | |
| D. | 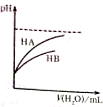 如图表示常温下HA、HB两种酸加水稀释时溶液pH的变化,则相同条件下,NaA溶液的pH大于NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 | |
| B. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代,利用此类光显微镜可以观察活细胞内蛋白质等大分子 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池放电过程中,负极质量一定减轻,正极质量一定增加 | |
| B. | 常温下浓硫酸与铝不反应,所以常温下可用铝制贮罐贮运浓硫酸 | |
| C. | 8NH3(g)+6NO2(g)=7N2(g)+12 H2O(g)△H<0该反应一定能自发进行 | |
| D. | 提取海带中的碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
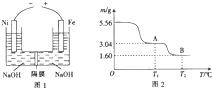 铝、铁及其化合物在工业生产中有着重要的应用.
铝、铁及其化合物在工业生产中有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
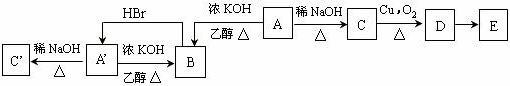
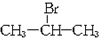 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com