
| 编号 | 1 | 2 | 3 |
| 混合物质量/g | 4.36 | 5.54 | 9.81 |
| 硫酸溶液体积/mL | 50.00 | 50.00 | 50.00 |
| 生成SO2的物质的量/mol | 0.03 | 0.0375 | 0.03 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、3.2L |
| B、2 L |
| C、1.8 L |
| D、1.5 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、SiO2、CO2、CO均为酸性氧化物 |
| B、稀豆浆、硅酸、水玻璃、氯化铁溶液均为胶体 |
| C、烧碱、冰醋酸、四氯化碳、NH3均为电解质 |
| D、BaSO4的水溶液不导电,但BaSO4是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
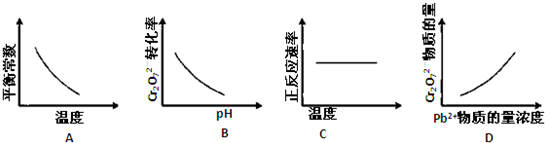
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
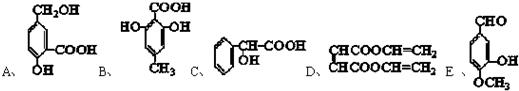
查看答案和解析>>
科目:高中化学 来源: 题型:
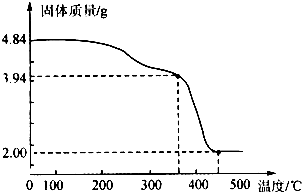
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com