
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
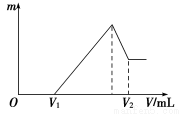
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=______________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
(1)0.06 440 (2)400 (3)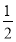 ≤a<1
≤a<1
【解析】(1)由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、Al反应的为H2SO4:
2 mol-0.16 mol×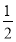 =0.12 mol。
=0.12 mol。
假设n(Mg)=x mol,n(Al)=y mol,
则有方程组:
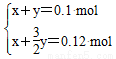 ,解得:x=0.06 mol,y=0.04 mol。
,解得:x=0.06 mol,y=0.04 mol。
当加入V2 mL NaOH溶液时,
得到Mg(OH)2沉淀和NaAlO2关系式为:
Mg2+~2OH-,Al3+~4OH-,
所以,V2=160 mL+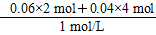 ×103 mL/L=440 mL。
×103 mL/L=440 mL。
(2)当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,
所以,V(NaOH)= 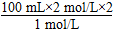 =400 mL。
=400 mL。
(3)当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:Na2SO4、NaAlO2。
则根据Na元素守恒:n(NaOH)=0.45 L×1 mol/L≥0.1 L×2 mol/L×2+0.1×(1-a)mol。
解得a≥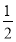 ,则满足此条件的a的取值范围是
,则满足此条件的a的取值范围是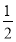 ≤a≤1。
≤a≤1。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-3练习卷(解析版) 题型:实验题
一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组分别从定性和定量两方面对此作了研究。
定性实验:按图组装好实验装置,微热试管A,观察实验现象。反应开始后,观察到A试管中Zn与浓硫酸反应,C、D、E中有气泡产生,随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失。反应较长时间后,C、D、E中的气泡量又会明显增加。试回答下列问题:
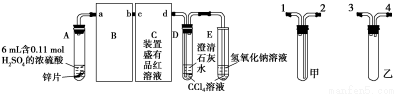
(1)从甲、乙装置选择合适的填入B、C中,并进行正确连接,a接 、 接b,c接 、 接d;D、E两支试管中CCl4的作用是 。
(2)能证明浓硫酸具有强氧化性的实验现象为 ;反应较长时间后气泡量又会明显增加的原因是 。
(3)一定量的浓硫酸与足量Zn充分反应时,有H2生成的理由是 ;实验过程中,浓硫酸表现强氧化性的反应方程式是 。D中浑浊消失的离子反应方程式是 。
定量实验:某化学实验研究性学习小组设计了以下实验,以定量测定反应中生成的SO2和H2的体积之比。
取A试管中充分反应后的溶液2 mL(假设反应前后溶液的体积不变),配制成100 mL溶液。然后取稀释液20.00 mL滴加BaCl2溶液使沉淀完全,过滤、洗涤、干燥沉淀,称量所得沉淀为1.4 g。
(4)完成定量实验部分所需的玻璃仪器有:滴管、玻璃棒、烧杯、量筒、干燥器、 、 、 、 、 等(可填满,也可以空缺)。
(5)计算反应中生成的SO2和H2的体积之比: 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-1练习卷(解析版) 题型:选择题
下列说法中,正确的是( )
A.酸性氧化物都不与酸溶液反应
B.陶瓷、水泥及所有的玻璃都是硅酸盐产品
C.某些非金属单质既能与酸反应也能与碱反应
D.硅酸盐都是难溶于水的
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-3练习卷(解析版) 题型:填空题
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C
为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
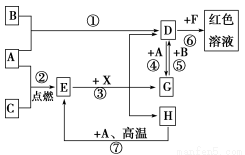
(1)写出化学式:A________、D________、E________、X________。
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应⑥的离子方程式为:_______________________________________。
(4)反应⑦的化学方程式为_________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式:_________________________
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-3练习卷(解析版) 题型:选择题
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-2练习卷(解析版) 题型:选择题
在含1 mol KAl(SO4)2的溶液中逐滴加入2 mol Ba(OH)2溶液,下列有关说法中正确的是( )
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-2练习卷(解析版) 题型:选择题
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解
②加烧碱溶液溶解
③过滤
④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀
⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③C.②③⑤③ D.①③⑤③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练2-3练习卷(解析版) 题型:填空题
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是____________________________________
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练1-3练习卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
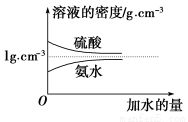
| 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与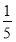 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________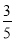 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com