
实验室里需用纯净的KCl固体,但目前只有含K2SO4、(NH4)2CO3杂质的KCl。某学生设计了如图所示方案进行提纯。
已知:1.(NH4)2CO3 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
2.K2SO4、KCl热稳定性好,KCl溶解度随温度变化不大;
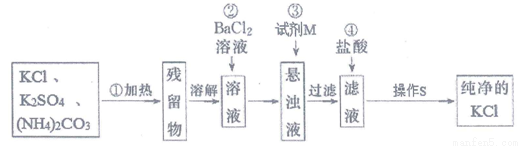
根据以上信息,回答下列问题:
(1)步骤①加热的目的是:______________;此操作可选择在______________(填仪器名称)中进行;
(2)步骤②不用硝酸钡溶液,其理由是_________________;
(3)进行步骤②时,简述判断SO42-是否除尽的实验操作、现象和结论:____________;
(4)步骤③所加试剂M为:_______________,其目的是_________________;
(5)操作S的名称是__________________。
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
某化学小组为测定下列各混合物中铝的质量分数,设计了如下实验方案:
①铜铝混合物 充分反应测定生成气体的体积
充分反应测定生成气体的体积
②铜铝混合物 充分反应测定剩余固体的质量
充分反应测定剩余固体的质量
③铜铝混合物 充分反应测定所得固体的质量
充分反应测定所得固体的质量
④铁铝混合物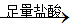 充分反应测定生成气体的体积
充分反应测定生成气体的体积
以上方案可行的是( )
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
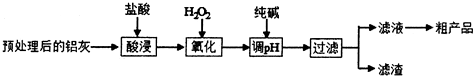
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 2.8 |
| A13+ | 3.4 | 4.7 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 离子 | Cu2- | Al3+ | H+ | Cl- | SO42- |
| c(mol/L) | 1 | 1 | 2 | 3 | a |
| A. | 电路中共转移0.9mol电子 | B. | 铝元素以Al(OH)3的形式存在 | ||
| C. | 阴极质量增加3.2g | D. | a=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y、Z原子的核外最外层电子数的总和为19 | |
| B. | W的阴离子半径小于Li+ | |
| C. | W与Y可形成既含离子键又含共价键的化合物 | |
| D. | X、Y的简单气态氢化物的稳定性:X>Y |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
将15mL 2mol/LNa2CO3溶液逐滴加入到40mL 1.5mol/LMCln盐溶液中,恰好将溶液中的Mn+完全沉淀为碳酸盐,则MCln中n值是()
A.4 B.3 C.2 D.l
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
| D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
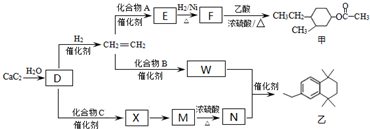
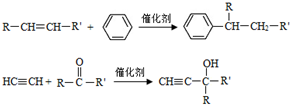 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)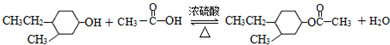 .
.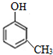 .
.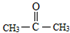 .
.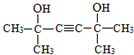 .
.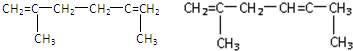 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com