
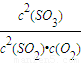 计算,再根据v=
计算,再根据v=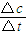 计算v(SO2);
计算v(SO2);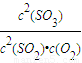 =
=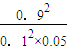 =1620,
=1620,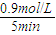 =0.18 mol/(L?min),
=0.18 mol/(L?min),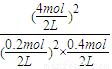 =2000>1620,不是平衡状态,反应逆向进行,故选C.
=2000>1620,不是平衡状态,反应逆向进行,故选C.

科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
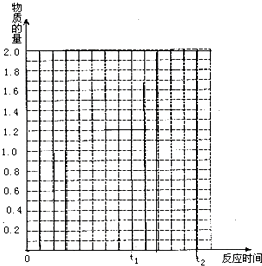 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应进行到t1时,SO2的体积分数___________;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将___________(填“增大”“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量___________2.1 mol(填“<”“>”或“=”),并简单说明原因____________________________________________;
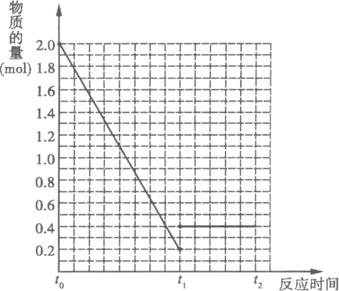
(4)若其他条件不变,在t1时再加入0.2 molSO2、0.1 mol O2和1.8 mol SO3,在图中作出从t0![]() t1
t1![]() t2点这段时间内SO2的物质的量变化曲线。
t2点这段时间内SO2的物质的量变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com