
(12分)某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: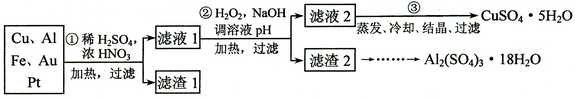
请回答下列问题:
⑴第①步Cu与酸反应的离子方程式______________ 。
⑵第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: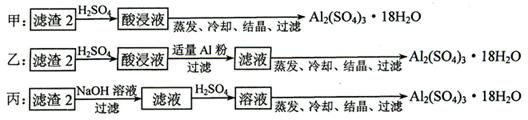
上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
科目:高中化学 来源: 题型:
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为,饱和亚硫酸中
。
(1)将0.1 mol• L—1的BaCl2溶液滴入饱和亚硫酸中,_______(填“能”或“不能”)生成BaSO3沉淀,原因是______________(请写出必要的推断过程)。
(2)浓硫酸的沸点为338°C,酒精灯火焰的温度为400〜5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3)乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4)丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
A. NaOH 溶液 B. Na[Al(OH)4]溶液 C. H2O2 溶液 D.酸性 KMnO4 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(本题共12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
|
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是_________________;D、E两支试管中CCl4的作用是_____________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:___________。设计实验验证你的猜想________________。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是_____。(写化学式)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三上学期开学考试化学试卷(解析版) 题型:实验题
(12分)某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
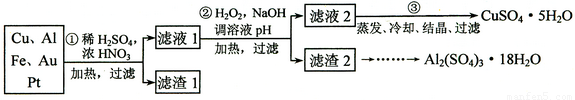
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式______________ 。
⑵ 第②步加H2O2的作用是_______________;调溶液pH的目的是使____________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
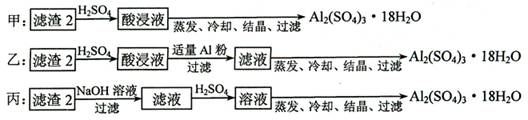
上述三种方案中,_______方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:
(08茂名市二模)(本题12分)某学习小组为探究S和Cl2能否反应,经查资料获得信息,干燥的Cl2在110℃~140℃与S反应,可得S2Cl2粗品,由此设计如下试验装置(夹持装置未画出),请回答后面问题。

(1)实验过程中,使用分液漏斗滴加浓盐酸的操作是 (2分)(2)用反应方程式表示H装置的作用 (2分)(3)写出B中反应的离子方程式 (2分)(4)C、D中的试剂分别是 , (2分)(5)经检测粗品中含有SCl2,为减少SCl2的生成,关键的操作是 (2分)(6)F导管可能会发生堵塞,请在C、D之间设计一个防堵塞装置以免发生危险。(要求画出装置图,标出试剂名称,夹持装置不需画出) (2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com