
| A. | KOH溶液和明矾的水溶液 | B. | Na2CO3溶液和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | 盐酸和NaAlO2溶液 |
分析 只用试管和胶头滴管而不用其它试剂就能区分,说明反应现象与反应物的量有关,结合物质间的反应来分析解答.
解答 解:A.将硫酸铝溶液滴加到KOH溶液中先没有现象,后生成沉淀,将KOH滴到硫酸铝溶液中先生成沉淀后沉淀消失,二者现象不同,可鉴别,故A不选;
B.当盐酸少量时,离子反应方程式为CO32-+H+=HCO3-,当盐酸过量时,离子反应方程式为2H++CO32-=CO2↑+H2O,所以反应现象不同,故B不选;
C.NaHCO3溶液和盐酸改变加入顺序均有气体生成,现象相同,不能鉴别,故C选;
D.当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,故D不选;
故选C.
点评 本题考查了物质间的反应,明确物质的性质是解本题关键,生成物与反应物的量有关,有的生成物与反应物浓度有关,如铜和浓稀硝酸反应产物不同,有的与反应条件有关,如钠和氧气反应生成氧化钠,在空气中燃烧生成过氧化钠,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 滴定管装液滴定时应先用标准溶液润洗 | |
| C. | 蒸馏时温度计的水银球处于蒸馏烧瓶支管附近 | |
| D. | 锥形瓶用作反应容器时,一定不能加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
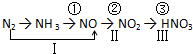
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
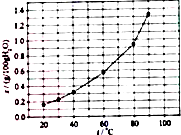
| A. | 溴酸银的溶解是吸热过程 | |
| B. | 温度升高时溴酸银溶解速度加快 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-3 | |
| D. | 若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、MnO4-、Na+、Cl- | B. | K+、Fe2+、NO3-、HCO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
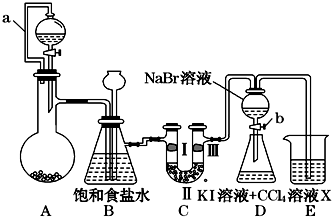 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com