
| A. | 溴水中有平衡:Br2+H2O=HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红 | |
| C. | 对CO+NO2=CO2+NO,平衡体系增大压强可使颜色变深 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.当加入AgNO3溶液后,硝酸银和HBr反应生成AgBr沉淀,促进平衡向右移动,导致溴浓度降低溶液颜色变浅,所以可以用勒夏特列原理解释,故A不选;
B.电解硫酸钠溶液时,溶液中水电离生成氢离子和氢氧根离子,阴极上氢离子放电生成氢气,从而促进水电离,导致溶液中氢氧根离子浓度增大,溶液呈碱性,无色酚酞试液遇碱变红色,所以可以用勒夏特列原理解释,故B不选;
C.增大压强时二氧化氮浓度增大导致气体颜色加深,与平衡移动原理无关,所以不能用勒夏特列原理解释,故C选;
D.合成氨是反应前后气体体积减小放热的可逆反应,降低温度促进平衡正向移动,从而提高氨气产率,所以可以勒夏特列原理解释,故D不选;
故选C.
点评 本题考查勒夏特列原理,侧重考查基本理论,明确其理论内涵及适用范围是解本题关键,易错选项是C,压强不影响该平衡,题目难度不大.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若金属有剩余,向溶液中再滴入硫酸后,金属可能溶解,也可能不溶解 | |
| B. | 若金属全部溶解,则溶液中一定含有Fe3+ | |
| C. | 若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | |
| D. | 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-$\frac{a}{3}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | C、D、E的半径:C>D>E | |
| D. | 化合物AE与CE有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | 原子最外层电子数是次外层的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 气态氢化物与最高氧化物对应水化物可发生化合反应 |
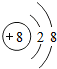 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式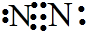 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过足量溴水 | |
| B. | 通入足量的酸性高锰酸钾溶液 | |
| C. | 燃烧 | |
| D. | 使乙炔在一定条件下与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | W与Y可形成既含极性共价键又含有非极性共价键的化合物 | |
| D. | XW4一定高于YW3的稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com