
����Ŀ�����ܼ����Ѿ���Ϊȫ���Ĺ�ʶ���㽭ʡ��ԭ�������Ҵ����͵Ļ����ϣ���ʼ�Ե�״�����![]() ��������������һ�����ļ״�
��������������һ�����ļ״�![]() �����ݼ������ݷ�����Ϊ��������ȫ�е�140������������ȫ��ʹ�ü״����ͣ�һ�����ܼ����к�����
�����ݼ������ݷ�����Ϊ��������ȫ�е�140������������ȫ��ʹ�ü״����ͣ�һ�����ܼ����к�����![]() һ����̼
һ����̼![]() �ŷŽ���100��֡��״�������ú�������������ɵ�CO��
�ŷŽ���100��֡��״�������ú�������������ɵ�CO��![]() ���Ʊ���CO+2H2
���Ʊ���CO+2H2![]() CH3OH��
CH3OH��

�����ͼʾ�ش��������⣺
(1)���ڸ÷�Ӧ������˵���У���ȷ����______![]() ����ĸ
����ĸ![]() ��
��
A.![]() ��
��![]()
![]() ��
��![]() C.
C.![]() ��
��![]()
![]() ��
��![]()
(2)�ֽ�������ʵ�飬�����Ϊ1L���ܱ������У�����1molCO��![]() �������CO��
�������CO��![]() ��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬CO��ƽ����Ӧ���ʦԣ�CO��=______���÷�Ӧ��ƽ�ⳣ��
��Ũ����ʱ��仯��ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬CO��ƽ����Ӧ���ʦԣ�CO��=______���÷�Ӧ��ƽ�ⳣ��![]() ______��
______��
(3)�жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־��______(����ĸ)��
a��������(CH3OH)=������(CO)
b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı�
d��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯
e. ��������ѹǿ���ٸı�
(4)���������£��ﵽƽ������д�ʩ����ʹ![]() �������______��
�������______��
A.�����¶� B.����He�� C.�ٳ���1molCO��![]() D.ʹ�ô���
D.ʹ�ô���
(5)����һ���ݵ��ܱ������г���1molCO��![]() ���ﵽƽ��ʱ��Ļ�������ѹǿ��ͬ��ͬѹ����ʼ��0.6�����˹����������ʾ�������̬����ƽ��ʱ��������ƽ��Ħ������
���ﵽƽ��ʱ��Ļ�������ѹǿ��ͬ��ͬѹ����ʼ��0.6�����˹����������ʾ�������̬����ƽ��ʱ��������ƽ��Ħ������![]() ______
______![]() �����������3λ��Ч���֣�
�����������3λ��Ч���֣�
���𰸡�C 0.075mol/(Lmin) ![]() cde C 17.8
cde C 17.8
��������
(1) ���ڷ�Ӧ��CO(g)+2H2(g)CH3OH(g)����������ʵ������٣�����ϵ�Ļ��ҶȽ��ͣ����S<0���������仯ͼ��2������������������������ڷ�Ӧ������������ɼ���ӦΪ���ȷ�Ӧ�����H<0�����ϣ���S<0����H<0��
��ѡC��
(2) �����Ϊ1L���ܱ������У�����1molCO��3molH2������Ũ�ȱ仯ͼ���ӷ�Ӧ��ʼ��ƽ�⣬CO�����ʵ���Ũ�ȸı���Ϊ��c=1mol/L0.25mol/L=0.75mol/L��ʱ���t=10min����CO��ƽ������Ϊ��(CO)=![]() =0.075mol/(Lmin)��
=0.075mol/(Lmin)��
��ӦCO(g)+2H2(g)CH3OH(g)����Ӧ��ƽ�ⳣ������ʽΪ��K=![]() ������Ũ�ȱ仯ͼ��ƽ��ʱ��c(CO)=0.25mol/L��c(H2)=3mol/L2��(10.25)mol/L=1.5mol/L��c(CH3OH)=0.75mol/L����ƽ�ⳣ��ΪK=
������Ũ�ȱ仯ͼ��ƽ��ʱ��c(CO)=0.25mol/L��c(H2)=3mol/L2��(10.25)mol/L=1.5mol/L��c(CH3OH)=0.75mol/L����ƽ�ⳣ��ΪK=![]() ��
��
����0.075mol/(Lmin)��![]() ��
��
(3) a��������(CH3OH)��������(CO)��Ϊ����Ӧ��������ʣ�����˵����Ӧ�Ƿ�ﵽƽ��״̬��
b�������������ʼ�ղ��䣬���������ʱ�����������ܶ�ʼ�ղ��䣬������ܶȲ��䲻��˵����Ӧ�Ƿ�ﵽƽ��״̬��
c����Ӧ��ϵ�����غ㣬���ʵ������ŷ�Ӧ������С����������ƽ����Է���������С����������ƽ����Է����������ٸı䣬��Ӧ�ﵽƽ�⣻
d��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯������ϵ�и���ֵĺ������ڱ仯��������Ϊ�жϷ�Ӧ�ﵽƽ������ݣ�
e. �÷�Ӧ����Ӧ�������������С�ķ�Ӧ������ƽ�����������������ʵ�����С����ϵѹǿ��С����������ѹǿ���ٸı䣬����Ϊ��Ӧ��ϵ�ﵽƽ������� ��
���� cde ��
(4) ��ӦΪCO(g)+2H2(g)CH3OH(g)���ں��������£��ﵽƽ��ı䷴Ӧ������
A. ��Ӧ���ʱ��H<0��Ϊ���ȷ�Ӧ�������¶ȣ���Ӧƽ�����淴Ӧ�����ƶ�������![]() ��С����A���������⣻
��С����A���������⣻
B. ���������³���He������He�����μӻ�ѧ��Ӧ���Ҳ��ı���ϵ�и���ֵ�Ũ�ȣ��Ի�ѧƽ�ⲻ����Ӱ�죬![]() ���䣬��B���������⣻
���䣬��B���������⣻
C. �ٳ���1molCO��3molH2�������˷�Ӧ��Ũ�ȣ��൱������ѹǿ��ʹƽ��������Ӧ�����ƶ�������ʹ![]() ����C�������⣻
����C�������⣻
D. ʹ�ô���ֻ�����̷�Ӧ����ƽ���ʱ�䣬���ı仯ѧ��Ӧ��ƽ��״̬����![]() ���䣬��D���������⣻
���䣬��D���������⣻
��ѡC��
(5)ͬ��ͬ���ʱ�������ѹǿ֮�ȵ������ʵ���֮�ȣ�Pƽ�⣺P��ʼ = n��ƽ�⣩�� n����ʼ��= n��ƽ�⣩����1mol+2mol��=0.6����n��ƽ�⣩=1.8 mol����ʼʱ��ϵ����������ƽ��ʱ��ϵ����������ȣ���m��ƽ�⣩=m����ʼ��=1mol��28g/mol+ 2mol��2g/mol=32g����ƽ��ʱ��������ƽ��Ħ������![]()
![]() =17.8g/mol��
=17.8g/mol��
����17.8



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A.78gNa2O2������ˮ��ַ�Ӧʱ����ת����ΪNA
B.2L1mol/LNa2SO4��Һ����������Ϊ3NA
C.25�棬101.3kPaʱ��11.2LH2�к��е�ԭ����ΪNA
D.4�棬101.3kPaʱ��54mlH2O�к��е�ԭ����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է�ӦA��B��AB��˵�������°�����������з�Ӧ��
��20 mL��Һ�к�A��B��0.01 mol
��50 mL��Һ�к�A��B��0.05 mol
��0.1 mol��L��1��A��B��Һ��10 mL
��0.5 mol��L��1��A��B��Һ��50 mL
���߷�Ӧ���ʵĴ�С��ϵ��
A.�ڣ��٣��ܣ���B.�ܣ��ۣ��ڣ���
C.�٣��ڣ��ܣ���D.�٣��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������᳣���ںϳ�������������ҽҩ��Ʒ����֪�� Һ�����ӷ��������ɫҺ�壬�е�Ϊ58.78�档��������Ϊ47%�����������ӷ�����ɫҺ�壬�е� Ϊ 126��. ʵ�����Ʊ���������Ϊ47%���������һ�ַ������¡��ش��������⣺
ʵ��]�� | ���� |
I .����ƿ�����μ���������ˮ��m1g Һ�壬��ͨ��SO2��ַ�Ӧ | �õ�����ɫ��Һ |
II. ������ I ������Һת����������ƿ������ | ��ƿ�еóȻ�ɫ�ֲ�Ʒ |
III.�ڲ��Ͻ����£�����ƿ�м�������Na2SO3��Һ | ��1����_____ |
IV.������������ Ba(OH)2 ��Һ | ��______ |
V.���ˣ���Һ����������������Ϊ47%��������m2g |
(2)���� II������װ����ͼ��ʾ�����ּг�װ��ʡ�ԣ�������a��������_________ ��װ���г�ȱʯ��������������Դ��ֱ���_________�� _______________��
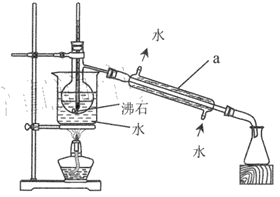
(3)����III��������Na2SO3 ������Ӧ�����ӷ���ʽΪ __________��
(4)��ҵ�����Ƶõ������᳣���е����Ļ�ɫ�� ��ͬѧ�Ʋ�����Ϊ��Fe3+�������Լ� __________���顣���۲쵽������Ϊ________�����Ʋ���ȷ��
(5)��������Ϊ 47%��������IJ���Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�������������Ӧʵ�����
A. ʵ������ȡ���ռ�NH3
ʵ������ȡ���ռ�NH3
B.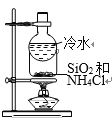 ����SiO2��NH4Cl
����SiO2��NH4Cl
C.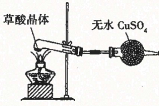 ������ᾧ�����Ƿ��нᾧˮ
������ᾧ�����Ƿ��нᾧˮ
D. ��֤���ȶ��ԣ�Na2CO3>NaHCO3
��֤���ȶ��ԣ�Na2CO3>NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T ��ʱ��A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȱ仯��ͼ(��)��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B�����������ʱ��Ĺ�ϵ��ͼ(��)��ʾ��
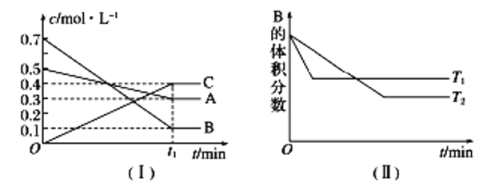
���������������ش��������⣺
(1)A��B��Ӧ����C�Ļ�ѧ����ʽΪ________������ӦΪ_____(����ȡ����ȡ�)��Ӧ��
(2)t1 min�ı�����ijһ��������ʹƽ�����淴Ӧ�����ƶ�����______(����ĸ���)��
A�����������������䣬����ѹǿ
B������������������䣬ͨ������ϡ������
C�����������������䣬�����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
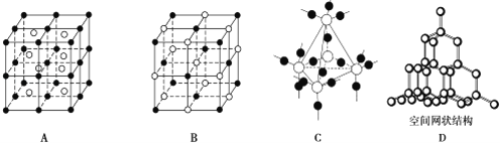
����Ŀ����1���ڢ�CO2����NaCl����Na����Si����CS2�����ʯ���ߣ�NH4��2SO4�����Ҵ��У��ɼ��Լ��γɵķǼ��Է�����_______������ţ�����ͬ�������н������ӵ�������__�����Ӽ���γ������������________���������Ӿ������__������ԭ�Ӿ������__���١����������ʵ��۵��ɸߵ��͵�˳����__��
��2��A��B��C��DΪ���־��壬�������£�
A����̬ʱ�ܵ��磬����������
B��������CS2��������ˮ
C����̬ʱ�����磬Һ̬ʱ�ܵ��磬������ˮ
D����̬��Һ̬ʱ�������磬�۵�Ϊ3500 ��
���ƶ����ǵľ������ͣ�A��__��B��__��C��__��D��__��
��3����ͼ��A��D����ѧ��ѧ�̿����ϳ����ļ��־���ṹģ�ͣ�����д��Ӧ���ʵ����ƣ�A��__��B��__��C��__D��____��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡ��ϩ����������֤��ϩ��ѧ���ʵ�ʵ��װ�ã�����B��ʢ�ŵ�����ˮ��C��ʢ�ŵ�������KMnO4��Һ��

��1��д�����з�����Ӧ�Ļ�ѧ����ʽ____________________________________��
��2��Bƿ�е�������__________________��Cƿ�е�������__________________���������������֤����ϩ��_____________�������������������������
��3��д��Bƿ�з�����Ӧ�ķ���ʽ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ϊ���������ں��º����ܱ������г���һ������NO��NH3����һ�������·�����Ӧ��6NO��g��+4NH3��g��![]() 5N2��g��+6H2O��g����
5N2��g��+6H2O��g����
һ�������£���2L�ܱ������ڣ���Ӧ2NO2![]() N2O4��n��NO2����ʱ��仯�����
N2O4��n��NO2����ʱ��仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
��NO2��ʾ0~2s�ڸ÷�Ӧ��ƽ����Ӧ����___���ڵ�5sʱ��NO2��ת����Ϊ___�����ݱ��п��Կ��������ŷ�Ӧ���У���Ӧ������С����ԭ����__��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com