

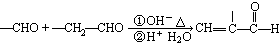

| NaCN |
| H+H2O |
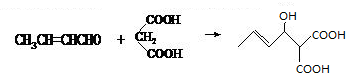 ,反应类型为:加成反应,
,反应类型为:加成反应, ;加成反应;
;加成反应; ,
, ;
;

科目:高中化学 来源: 题型:
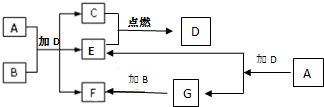 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol |
B、 向弱酸HA的稀溶液中加水稀释 |
C、 有正催化剂(a)和无催化剂(b)时反应的能量变化 |
D、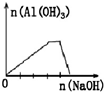 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 6 | 0 | 放出热量b kJ |
| ③ | 0 | 0 | 2 | 吸收热量c kJ |
| A、热量值关系一定满足:a=c<92.4 |
| B、三个容器内反应的平衡常数:③>①>② |
| C、达平衡时氨气的体积分数:①<② |
| D、N2的转化率:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )| A、对应简单离子半径:X>W>Y>Z |
| B、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
| C、X、W两元素形成的二元化合物中一定含有离子键 |
| D、对应气态氢化物的稳定性W>Y,对应气态氢化物的熔沸点Y>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com