
| A. | 配制该溶液应用托盘天平称取12.5g胆矾 | |
| B. | 配制该溶液应用托盘天平称取8.0g胆矾 | |
| C. | 转移溶液前容量瓶内有少量蒸馏水会使所配溶液浓度偏低 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
分析 用CuSO4•5H2O配制480mL 0.1mol.L-1的CuSO4溶液,实际上配制的是500mL 0.1mol.L-1的CuSO4溶液,依据m=cVM计算需要CuSO4•5H2O的质量,注意体积为溶液体积,不是溶剂的体积,据此进行解答.
解答 解:A.实际上配制的是500mL 0.1mol.L-1的CuSO4溶液,需要胆矾的质量为:250g/mol×0.1mol/L×0.5L=12.5g,故A正确;
B.根据A可知,配制该溶液需要胆矾的质量为12.5g,故B错误;
C.容量瓶中有少量蒸馏水,对配制的溶液浓度没有影响,故C错误;
D.摇匀后再加入水,导致配制的溶液体积偏大,溶液浓度偏低,故D错误;
故选A.
点评 本题考查配制一定物质的量浓度的溶液,为高频考点,题目难度不大,侧重于学生的分析能力、计算能力和实验能力的考查,注意物质的量浓度溶液中体积为溶液体积,非溶剂体积.


科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
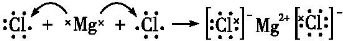 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
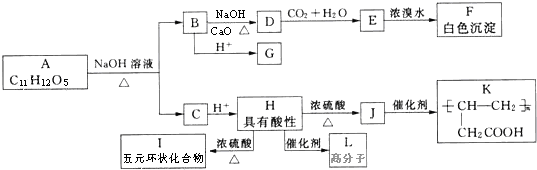
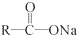 +NaOH $→_{△}^{CaO}$R-H+Na2CO3
+NaOH $→_{△}^{CaO}$R-H+Na2CO3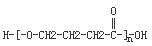 +(n-1)H2O.
+(n-1)H2O.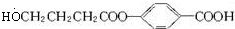 ;A生成B和C的反应方程式:
;A生成B和C的反应方程式: .
.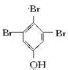 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaHCO3固体,v(H2)不变 | B. | 加入少量Na2SO4固体,v(H2)增大 | ||
| C. | 加入少量NaHSO4固体,v(H2)增大 | D. | 加入少量CuSO4溶液,v(H2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷 | B. | 乙烷和丙烷 | C. | 乙烷和甲烷 | D. | 戊烷和己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com