
【题目】“北京烤鸭”举世闻名.制作烤鸭套餐的部分原料如下:①鸭肉、②面粉、③黄瓜、④食盐.请回答:
(1)富含淀粉的是 (填序号,下同).
(2)富含蛋白质的是 .
(3)富含维生素的是 .
(4)属于调味剂的是 .
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ag/A12O3催化剂在工业上具有广泛用途。废银催化剂中银的回收既可节约资源,又有较好的经济效益。回收银的简化流程如下图所示(部分条件和试剂略):

请回答下列问题:
(1)第I步中,载体A12O3不与稀硝酸反应。Ag和稀硝酸反应产生的气体是____________。
(2)第II步中,饱和食盐水由工业食盐水提纯而得。除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是_________(填字母编号)。
a.加入稍过量的NaOH溶液
b.加入稍过量的BaC12溶液
c.过滤
d.加入稍过量的Na2CO3溶液
e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是____________ 。
(4)N2H4具有还原性,氧化产物为N2。第IV步反应的产物除Ag和N2外,还有的物质是_______(填化学式)。
(5)N2H4可用作火箭推进剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是______________________。
(6)Ag可制备银锌纽扣电池正极材料Ag2O,碱性条件下该电池的正极反应式是____。
(7)若上述流程中第I、II、III步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
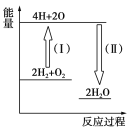
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。
则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室需要450 mL 0.02 mol/L酸性KMnO4标准溶液,现有仪器:
① 托盘天平 ② 玻璃棒 ③ 药匙 ④ 200mL烧杯 ⑤ 量筒,还需要 玻璃仪器才能完成配制,需称量KMnO4固体 g。
(2)下列操作会使配制的KMnO4溶液浓度偏大的是 (填写编号,假设其他操作均正确)。
A.没有冷却至室温就转移液体到容量瓶并完成定容 |
B.使用容量瓶配制溶液,定容时,俯视刻度线 |
C.没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中 |
D.容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液 |
E.定容时,滴加蒸馏水,不慎液面略高于刻度线,吸出少量水使凹液面最低点与刻度线相切
(3)配平下面的方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□H2C2O4+□H2SO4——□MnSO4+□K2SO4+□H2O+□CO2↑
(4)人体血液里Ca2+的浓度一般以mg/cm3为单位。为测定血液样品中Ca2+的浓度,抽取血样20.00 mL,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用上述标准0.02 mol/L 酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗13.00 mL酸性 KMnO4溶液,请计算血液样品中Ca2+的浓度为_________mg/cm3(保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g) + bB (g) ![]() cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是

A.前12s内,A的平均反应速率为0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b :c=1 :2
D.12s内,A和B反应放出的热量为0.2Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分离说法正确的是
A.检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作
B.碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色
C.可用加热法分离NH4Cl(s)和I2(s)
D.蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为A12O3,还含有Fe2O3、FeO、SiO2) 中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
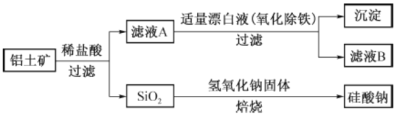
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
![]()
②检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为 (填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
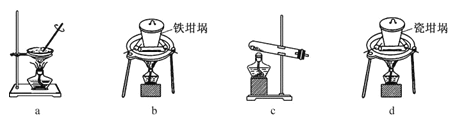
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com