
����Ŀ����1��������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���Һ��___������������������������������������ͬ������Һ��c(Na��)___c(CH3COO��)������>��������������<������
��2��pH��3�Ĵ����pH��11������������Һ�������Ϻ���Һ��___����Һ��c(Na��)___c(CH3COO��)��
��3�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����Ϻ���Һ��___���������___����������Һ�����
��4�������£�Ksp(PbI2)=8.5��10-9��ȡ������ɫPbI2��ĩ����ˮ�У���������õ���Һ�����ˡ�����Һ�м�������KI�����c(I-)=1.0��10-2mol��L-1����c(Pb2+)=___��
���𰸡����� > ���� < ���� > 8.5��10-5mol/L
��������
��1��������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���ǡ����ȫ��Ӧ������CH3COONa��ˮ������CH3COO-+H2O![]() CH3COOH+OH-���ɵó���Һ������Լ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
CH3COOH+OH-���ɵó���Һ������Լ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
��2������Ϊ���ᣬpH��3�Ĵ����pH��11������������Һ�������Ϻ�����ʣ�࣬ʣ��Ĵ��ᷢ�����룬CH3COOH![]() CH3COO-+H+���ɴ˿�ȷ����Һ������Լ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
CH3COO-+H+���ɴ˿�ȷ����Һ������Լ���Һ��c(Na��)��c(CH3COO��)�Ĺ�ϵ��
��3�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����ݵ���غ㣬�ɵó���Һ��c(H+)��c(OH-)�Ĺ�ϵ���Ӷ�ȷ����Ϻ���Һ������Լ��������������������Һ����Ĺ�ϵ��
��4����Һ��PbI2�ﵽ�����ܽ�ƽ�⣬��������KI�����c(I-)=1.0��10-2mol��L-1����Ksp(PbI2)= c(Pb2+)c2(I-)�������c(Pb2+)��
��1��������������ʵ���Ũ�ȵĴ��������������Һ��Ϻ���ǡ����ȫ��Ӧ������CH3COONa��ˮ������CH3COO-+H2O![]() CH3COOH+OH-��ʹ��Һ�ʼ��ԣ�����CH3COO-ˮ�⣬������Ũ�ȼ�С������c(Na��)>c(CH3COO��)����Ϊ�����ԣ�>��
CH3COOH+OH-��ʹ��Һ�ʼ��ԣ�����CH3COO-ˮ�⣬������Ũ�ȼ�С������c(Na��)>c(CH3COO��)����Ϊ�����ԣ�>��
��2������Ϊ���ᣬpH��3�Ĵ����pH��11������������Һ�������Ϻ�����ʣ�࣬ʣ��Ĵ��ᷢ�����룬CH3COOH![]() CH3COO-+H+��������Һ�����ԣ���Һ��CH3COONa=CH3COO-+Na+���ټ���CH3COOH
CH3COO-+H+��������Һ�����ԣ���Һ��CH3COONa=CH3COO-+Na+���ټ���CH3COOH![]() CH3COO-+H+������c(Na��)<c(CH3COO��)����Ϊ�����ԣ�<��
CH3COO-+H+������c(Na��)<c(CH3COO��)����Ϊ�����ԣ�<��
��3�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����ݵ���غ㣬�ɵó���Һ��c(H+)=c(OH-)���Ӷ�ȷ����Ϻ���Һ�����ԣ������߸պ���ȫ��Ӧ�������ڴ�������ӵ�ˮ���ʹ��Һ�Լ��ԣ�������Һ�����ԣ���˵��������������Դ������>����������Һ�������Ϊ�����ԣ�>��
��4����Һ��PbI2�ﵽ�����ܽ�ƽ�⣬��������KI�����c(I-)=1.0��10-2mol��L-1����Ksp(PbI2)= c(Pb2+)c2(I-)�������c(Pb2+)=![]() ��
��
����8.5��10-5mol/L��


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������������������ȷ���ǣ� ��
A.9g��13CO2��N217O�Ļ����������������Ϊ4.6NA
B.7.8��Na2O2�к���������Ϊ0.3NA
C.50 mL 12 mol��L-1����������MnO2����,ת�Ƶĵ�����Ϊ0.3NA
D.5.6����������2.24L������ַ�Ӧ��ת�Ƶ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ��NaHB��ˮ��Һ�У�HB���ĵ���̶�С��HB����ˮ��̶ȣ�����˵����ȷ���ǣ�������
A.NaHB�Ĵ���������ˮ�ĵ���
B.HB��ˮ�ⷽ��ʽ��HB��+H2O![]() H3O++B2��
H3O++B2��
C.��ͬ���ʵ���Ũ����Һ��pHֵ��NaHB��Na2B
D.��Һ������Ũ�ȴ�СΪ��c��Na+����c��HB������c��OH������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����з�Ӧ�������Է����е���
A.2O3(g)=3O2(g) ��H<0
B.CaCO3(s)=CaO(s)+CO2(g) ��H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) ��H<0
2NH3(g) ��H<0
D.2CO(g)=2C(s)+O2(g) ��H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Һ�У��������µ���ƽ�⣺HFH++F-
(1)�������NaOH������ƽ����______��Ӧ�����ƶ���c(H+)______ ��
(2)�������NaF������ƽ����______��Ӧ�����ƶ�.
(3)�����¶ȣ�����ƽ����______��Ӧ�����ƶ�.
(4)�����£�С�մ���Һ��______�ԣ�ԭ����_________________________���ñ�Ҫ�����ӷ���ʽ�����ֽ��ͱ�ʾ��.
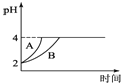
(5)�����£�ȡpH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ______������A������B�������������м����Zn����Ϊm1��������Һ�м����Zn����Ϊm2��m1______m2��ѡ����>������=����<����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������֤����Ӧ![]()
![]() �Ѵﵽƽ��״̬����
�Ѵﵽƽ��״̬����![]()
A.1��![]() �ֽ��ͬʱ����3��
�ֽ��ͬʱ����3��![]() ���γ�
���γ�
B.1��![]() �ֽ��ͬʱ����3��
�ֽ��ͬʱ����3��![]() �ķֽ�
�ķֽ�
C.1��![]() �ֽ��ͬʱ����1��
�ֽ��ͬʱ����1��![]() �ķֽ�
�ķֽ�
D.1��![]() �ֽ��ͬʱ����2��
�ֽ��ͬʱ����2��![]() ���γ�
���γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѧ�߳ɹ�ʵ���õ�����ˮ����������װ������ͼ��ʾ��

����˵����ȷ����
A. ��ͼ�е�����ת����ʽֻ��2��
B. a�������ĵ缫��ӦΪN2 + 6H�� + 6e�� = 2NH3
C. װ�ù���ʱH�� ��b�����ƶ����������ҺpH��С
D. a������b������������������ʵ���֮��Ϊ1 ��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)��¶�ڿ��������ױ�ը����������������ȼ�ϵ����һ������ĵ�أ���������������ת���ʸߡ���������Ⱦ���ص㣬�乤��ԭ����ͼ��ʾ������������ȷ����(����)
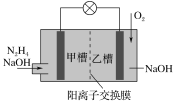
A. ��ع���ʱ������������pH����
B. ������1 mol O2ʱ����2 mol Na���ɼײ����Ҳ�Ǩ��
C. ������ӦΪ4OH����N2H4��4e��===N2����4H2O
D. ��ȥ�������ӽ���Ĥ�����Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��������������Һ����0.1mol/L��CH3COOH��Һ����pH=13��NaOH��Һ����0.05mol/L��H2SO4��Һ����0.1mol/L��Na2CO3��Һ���������й�˵������ȷ���ǣ� ��
A.��Һ���Լ��ԣ������ӷ���ʽ������ԭ��ɱ�ʾ�ɣ�CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.������������Һ�У�pH�ɴ�С��˳��Ϊ���ڢܢ٢�
C.�����¶���amL����Һ����bmL����Һ�ۻ�ϣ����û����Һ��pH=7����a��b=1��2
D.������Һ�ܺ�Al2(SO4)3��Һ��ϣ�һ���ɹ۲쵽�а�ɫ��״��������ɫ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com