
| A. | Ba(NO3)2溶液 | B. | 饱和澄清石灰水 | C. | Na2SO4溶液 | D. | 饱和Na2CO3溶液 |
分析 A、碳酸不能与强酸盐Ba(NO3)2反应生成强酸和弱酸盐;
B、当CO2过量时生成碳酸氢钙;
C、碳酸不能与强酸盐Na2SO4反应生成强酸和弱酸盐;
D、碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3.
解答 解:A、因酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐,像本选项中碳酸不能与强酸盐Ba(NO3)2反应生成强酸和弱酸盐,所以自始至终也不出现浑浊,故A错误;
B、石灰水与CO2反应生成碳酸钙沉淀,当CO2过量时,碳酸钙又与二氧化碳和水继续反应生成碳酸氢钙而使沉淀消失.故B错误;
C、因酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐,由于碳酸的酸性小于H2SO4 的酸性,所以碳酸不能与Na2SO4反应,故C错误;
D、因碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3,故最终有碳酸氢钠析出而使溶液变浑浊,故D正确;
故选:D.
点评 本题考查了CO2的相关性质,酸与盐反应一般规律是:强酸与弱酸盐反应生成弱酸和强酸的盐.但要注意在酸与盐反应的问题上有些特例,如CuSO4+H2S═CuS↓+H2SO4.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
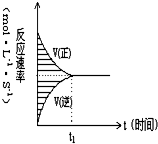 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )| A. | X的浓度的减少 | B. | Y的物质的量的减少 | ||
| C. | Y的浓度的减少 | D. | X的物质的量的减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用澄清石灰水来区分二氧化碳和二氧化硫 | |
| B. | 可用无水硫酸铜检验酒精中是否含少量水 | |
| C. | 能使灼热的CuO由黑变红的气体一定是H2 | |
| D. | 可用石蕊试液来鉴别盐酸和醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,但不与水反应 | |
| B. | 泡花碱属于盐类 | |
| C. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| D. | 玻璃和陶瓷都属于传统硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 2mol NO中含2mol氮和2mol O | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 1mol O22-的质量为34g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
| 物质 | 相对分子 质量 | 密度/ (相对于水) | 沸点/℃ | 溶解性 |
| 苯甲醛 | 106 | 1.046 | 178.8 | 微溶于水,可混溶于乙醇、乙醚、苯、氯仿 |
| 苯甲醇 | 108 | 1.042 | 205.7 | 溶于水,易溶于乙醇、醚、芳烃 |
| 苯甲酸 | 122 | 1.271 | 249.2 | 微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳 |
| 苯甲酸钠 | 144 | 1.442 | 249.3 | 溶于水和乙醇、甘油、苯、甲醇、微溶于乙醚 |
| 温度/℃ | 25 | 50 | 95 |
| 溶解度/g | 0.17 | 0.95 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学兴趣小组根据反应:Mg+H2SO4═MgSO4+H2↑设计测定镁原子摩尔质量的实验,实验的简易装置如图,除去表面氧化膜的镁条的质量为0.24g.镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积),下列关于该实猃的叙述不正确的是( )
某化学兴趣小组根据反应:Mg+H2SO4═MgSO4+H2↑设计测定镁原子摩尔质量的实验,实验的简易装置如图,除去表面氧化膜的镁条的质量为0.24g.镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积),下列关于该实猃的叙述不正确的是( )| A. | 实验前应检验装置的气密性 | |
| B. | 装置乙中的水不可以用NaCl溶液代替 | |
| C. | 读数时,应使装置乙和装置丙中的液面处于同一水平面上 | |
| D. | 镁原子的摩尔质量为24.0 g.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com