
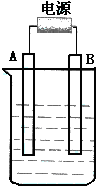
 ��ͼ��ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬�۲쵽A�缫�����к�ɫ�Ĺ�̬�������ɣ�B�缫����ɫ�������ɣ�����Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g����ش��������⣺
��ͼ��ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬�۲쵽A�缫�����к�ɫ�Ĺ�̬�������ɣ�B�缫����ɫ�������ɣ�����Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g����ش��������⣺���� ��ʯī���缫�ĵ����У�����500mL��һ�����ʵ�ij��ɫ��Һ���е�⣬˵������ͭ���ӣ��۲쵽A�缫�����к�ɫ�Ĺ�̬�������ɣ���A�缫����Cu���ɣ���AΪ������BΪ������B�缫����ɫ�������ɣ�B�缫�����������ɣ�������Ϊ�����Եĺ�����ͭ�Σ�����Һ�е�ԭ��������ȫ����ֹͣ��⣬ȡ��A�缫��ϴ�ӡ�����������缫����1.6g����n��Cu��=$\frac{1.6g}{64g/mol}$=0.025mol��
��1���������ӵ�Դ������AΪ������BΪ������
��2�����������������ӷŵ�����������������ͭ���ӷŵ�����ͭ�����������缫��Ӧʽ��Ӽ��õ�ط�Ӧʽ��
��3���������������������ɣ�������Һ�����ԣ�
��4����CH4��KOH��ҺΪԭ�Ͽ���Ƴ�ȼ�ϵ�أ�ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫�Ǹ�����ͨ���������ĵ缫����������ȼ�ϵ���и����ϼ���ʧ���Ӻ�KOH��Ӧ����̼��غ�ˮ�������������õ��Ӻ�ˮ��Ӧ�������������ӣ�
����ת�Ƶ��Ӽ����������������
��� �⣺��1�����Һ����ɫ��Һ��A�缫�����к�ɫ�Ĺ�̬�������ɣ�����A����ͭ���ӵõ��ӣ�����A����������A�ӵ��ǵ�Դ�ĸ�����B�缫����ɫ�������ɣ���һ����������ʧ���Ӳ���������������B�Ǹ�װ���������͵�Դ������������
�ʴ�Ϊ������������
��2��������Ӧ��4OH-=4e-+2H2O+O2����������Ӧ��2Cu2++4e-=2Cu�����ʱ��Ӧ�������ӷ���ʽΪ��2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+4H++O2����
�ʴ�Ϊ��4OH-=4e-+2H2O+O2����2Cu2++4e-=2Cu��2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+4H++O2����
��3�����ݵ�ⷽ��ʽ2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+4H++O2����֪��Ӧ���������ӣ�����ҺPH��С���ʴ�Ϊ����С��
��4������ȼ�ϵ�ع���ʱ�������������õ��Ӻ�ˮ��Ӧ�������������ӣ�����������ӦʽΪO2+4e-+2H2O=4OH-��
��������������Ӧ������ʧ���ӱ�������Ӧ�������缫��ӦʽΪCH4-8e-+10OH-=CO32-+7H2O��
������·�д���ת�Ƶ����غ㣬����ת�Ƶ����غ�������������=$\frac{\frac{2.8L}{22.4L/mol}��8}{4}��22.4L/mol$=5.6L��
�ʴ�Ϊ��O2+4e-+2H2O=4OH-��CH4-8e-+10OH-=CO32-+7H2O��5.6��
���� ���⿼����ԭ����Ϊ��Ƶ���㣬���ؿ���ѧ��������������������ȷ�����缫�Ϸ����ķ�Ӧ�ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д��ע���ϵ������Һ�������д����Ŀ�Ѷ��еȣ�


 ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������� | |
| B�� | ����ˮ���ܷ���ȡ����Ӧ�����ܷ����ӳɷ�Ӧ | |
| C�� | 1mol������������5mol���������ӳɷ�Ӧ | |
| D�� | ����Na2CO3��Һ��Ӧ����������NaHCO3��Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƵĽ����������ͭǰ�棬���Խ����ƿ����û�������ͭ��Һ�е�ͭ | |
| B�� | ��������ʢ�ź�����Ũ���� | |
| C�� | ��������ˮ�γɵ�Al��OH��3����������ˮ�������������ˮ�ľ��� | |
| D�� | ��������Ʒ���渲��������Ĥ�����ڲ������𱣻����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��CH3COO-����c��Na+�� | B�� | c��CH3COO-��c��Na+�� | ||
| C�� | c��CH3COO-��=c��Na+�� | D�� | ��ȷ��c��CH3COO-����c��Na+���Ĺ�ϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ϡ�����У�FeS+2H+�TFe2++H2S�� | |
| B�� | NH4HCO3���ڹ�����NaOH��Һ�У�HCO3-+OH-�TCO32-+H2O | |
| C�� | �ô�����������β���е�CO��NO��CO+NO$\stackrel{����}{��}$C+NO2 | |
| D�� | ����ʯ���ڴ����У�CaCO3+2CH3COOH�TCa2++2CH3COO-+CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��
����ƽ�ⳣ������Ka��ʾ���Ĵ�С�����жϵ���ʵ����ǿ����25��ʱ���й����ʵĵ���ƽ�ⳣ�����±���ʾ��| ��ѧʽ | HF | H2CO3 | HClO |
| ����ƽ�ⳣ����Ka�� | ��7.2��10-4 | K1=4.4��10-7 K2=4.7��10-11 | ��3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com