
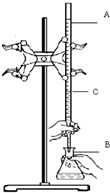
 在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:
在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:分析 (1)配制100mL一定浓度的盐酸,选择100mL容量瓶;
(2)由图可知,A中有活塞,为酸式滴定管,滴定管的下方没有刻度,但充满液体;
(3)盐酸滴定某未知浓度的NaOH溶液,锥形瓶中为NaOH,以甲基橙为指示剂,滴定前为黄色,发生中和反应后,颜色变为橙色.
解答 解:(1)配制100mL一定浓度的盐酸,需选用100mL容量瓶,故答案为:B;
(2)图中仪器A的名称是酸式滴定管,其规格为25.00mL,若C处液面读数为15.00mL,滴定管的下方没有刻度,但充满液体,则滴定管内所装溶液的体积大于(25.00mL-15.00mL),即大于10.00mL,则选C,
故答案为:酸式滴定管;C;
(3)盐酸滴定某未知浓度的NaOH溶液,锥形瓶中为NaOH,以甲基橙为指示剂,滴定前为黄色,达到滴定终点时颜色变化为由黄色变为橙色,半分内不立即变回黄色,锥形瓶B中发生反应的离子方程式为H++OH-=H2O,
故答案为:由黄色变为橙色,半分内不立即变回黄色;H++OH-=H2O.
点评 本题考查物质含量测定实验,为高频考点,把握溶液配制、中和滴定的应用等为解答的关键,侧重分析与实验能力的考查,注意仪器的使用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 滴定管用水洗后,未用标准溶液润洗就装入标准溶液 | |
| B. | 用于取待测液的滴定管未用待测液润洗 | |
| C. | 在摇动锥形瓶的过程中不慎溅出了一小部分溶液 | |
| D. | 标准液读数时,滴定前仰视,滴定后俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
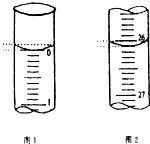 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
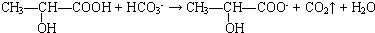
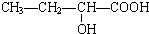 、
、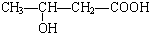 、
、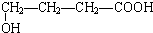
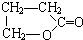 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熵变小于零而焓变大于零的反应肯定不能自发发生 | |
| B. | 热化学方程式中△H的值与反应物的用量有关 | |
| C. | 化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 | |
| D. | 其他条件不变,增大反应物浓度是通过增大活化分子百分数,使化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
| 压强(kPa) | 200 | 500 | 1 000 |
| B的浓度(mol•L-1) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com