
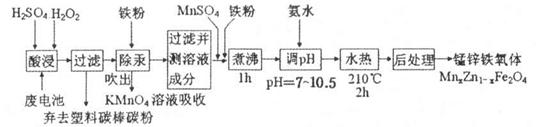
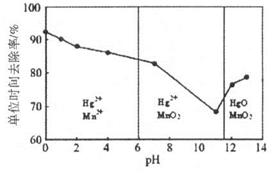


科目:高中化学 来源:不详 题型:单选题
| A.①③⑤②④ | B.②①③④⑤ |
| C.②④①③⑤ | D.③①②⑤④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
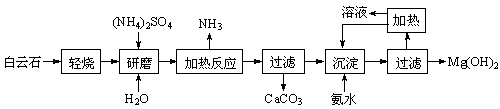
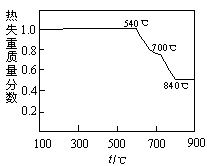
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.可以利用某些炼钢废渣来生产磷肥 |
| B.具有永久硬度的水主要用加热的方法来进行软化 |
| C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量 |
| D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳 |
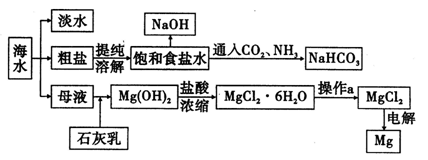
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
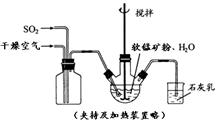
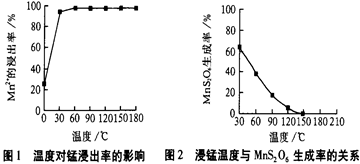
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用蒸馏或离子交换等方法淡化海水 |
| B.海水提溴只涉及物理变化 |
| C.利用海水可以制取金属Mg |
| D.开发海洋资源不能以牺牲环境为代价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
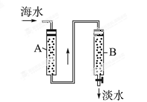
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com