
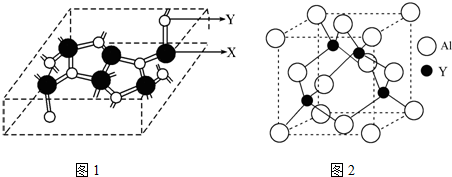
分析 X、Y、Z三种元素的基态原子具有相同的能层和能级,应为同周期元素,且第一电离能:I1(X)<I1(Z)<I1(Y),其中基态Y原子的2p轨道处于半充满状态,则Y是N元素,X的原子序数小于Y且其能层和能级相同,所以X是C元素,Z的原子序数大于Y,Z是O元素,
(1)C形成的同素异形体C60属于分子晶体;
(2)区分晶体和非晶体最可靠的科学方法是对固体进行X-线折射实验;
(3)由以上分析可知Y为氮元素;
(4)W由C、N两元素组成,为原子晶体,影响晶体的沸点高低的因素为共价键的键长;
(5)晶体中C原子与4个N原子成键,N原子与3个C原子成键,并用1个孤电子对,都为sp3杂化;
(6)①原子晶体具有超耐高温、超抗冲击性质;
②原子晶体中的化学键类型为共价键.
解答 解:X、Y、Z三种元素的基态原子具有相同的能层和能级,应为同周期元素,且第一电离能:I1(X)<I1(Z)<I1(Y),其中基态Y原子的2p轨道处于半充满状态,则Y是N元素,X的原子序数小于Y且其能层和能级相同,所以X是C元素,Z的原子序数大于Y,Z是O元素,
(1)C形成的同素异形体由金刚石、石墨、C60等,属于分子晶体的同素异形体为C60,故答案为:C60;
(2)区分晶体和非晶体最可靠的科学方法是对固体进行X-线折射实验,故答案为:X-线折射;
(3)由以上分析可知Y为氮元素,故答案为:氮元素;
(4)W由C、N两元素组成,硬度超过金刚石,则W为原子晶体,由于C-N键的键长小于C-C键,键能大于C-C键,则硬度超过金刚石,
故答案为:原子晶体;C-N键的键长小于C-C键,键能大于C-C键;
(5)晶体中C原子与4个N原子成键,N原子与3个C原子成键,并用1个孤电子对,都为sp3杂化,故答案为:sp3;sp3;
(6)①N与Al可形成一种超耐高温、超抗冲击的晶体,具有原子晶体的性质,应为原子晶体,故答案为:原子晶体;
②原子晶体中的化学键类型为共价键,故答案为:共价键.
点评 本题考查了元素位置结构的关系,为高考常见题型,侧重于学生的分析能力的考查,正确推断元素是解本题关键,涉及晶体、化学键以及杂化类型的判断,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
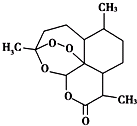 2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素易溶于乙醇、苯 | |
| C. | 青蒿素因含有-O-(醚键)而具有较强的氧化性 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 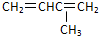 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. | CH3CH(OH)CH2CH32-羟基丁烷 | ||
| C. |  顺-2-丁烯 顺-2-丁烯 | D. | CH3CH(NH2)CH2COOH 3-氨基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL3mol/L 的 X 溶液 | B. | 20mL2mol/L 的 X 溶液 | ||
| C. | 10mL4mol/L 的 X 溶液 | D. | 10mL2mol/L 的 X 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com