


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白铁(镀锌)的表面一量破损,铁腐蚀加快 |
| B、原电池中电子向负极流动 |
| C、马口铁(镀锡)的表面一旦破损,铁腐蚀加快 |
| D、用铝质铆钉接铁板,铁易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
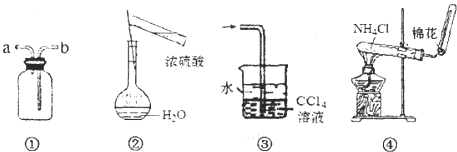
| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B、正极为C,负极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Pt,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com