
| A. | 我国首艘航母“辽宁舰”上用于载机降落的拦阻索是特种钢缆,属于金属材料 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等颗粒物的产生 | |
| C. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 | |
| D. | 高纯度的硅单质广泛用于光导纤维,光导纤维遇强碱会造成“短路” |
分析 A.钢缆的主要成分为铁;
B.高性能的耐磨轮胎,可减少细颗粒物的产生,减少空气污染;
C.释放的HCHO转化为无害物质,减少对环境的污染;
D.硅不能用于光导纤维.
解答 解:A.钢缆的主要成分为铁,为金属材料,故A正确;
B.高性能的耐磨轮胎,可减少细颗粒物的产生,可减少PM2.5等颗粒物的产生,故B正确;
C.释放的HCHO转化为无害物质,减少对环境的污染,则采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质合理,故C正确;
D.硅可导电,不能用于光导纤维,光导纤维的材料为二氧化硅,可用于碱反应,故D错误.
故选D.
点评 本题考查物质的性质及应用,为高频考点,侧重于分析与应用能力的考查,注意把握物质的性质、环境保护、化学与生活的关系为解答该题的关键,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:实验题
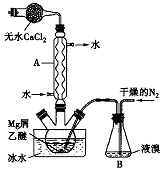 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
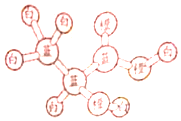 某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )
某有机物分子的球棍模型如图所示,图中“棍”代表化学键,不同颜色的“球”代表不同元素的原子,下列说法错误的是( )| A. | 1mol该有机物可与2molNa反应,生成1mol气体 | |
| B. | 该有机物可以发生加聚反应 | |
| C. | 该有机物可以发生取代反应,氧化反应、酯化反应 | |
| D. | 该有机物可以生成分子式为C6H8O4的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精灯外焰加热铝箔,铝箔熔化但不滴落,说明Al2O3>Al | |
| B. | 锅炉水垢CaSO4可用Na2CO3溶液浸泡,再用酸溶解去除,说明Ksp:CaCO3>CaSO4 | |
| C. | 向Na2SiO3溶液中通入适量CO2气体,有白色沉淀生成,说明酸性:H2CO3>H2SiO3 | |
| D. | 当光束通过淀粉溶液时,出现一条光亮的“通路”,说明分散质微粒的直径在1-100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
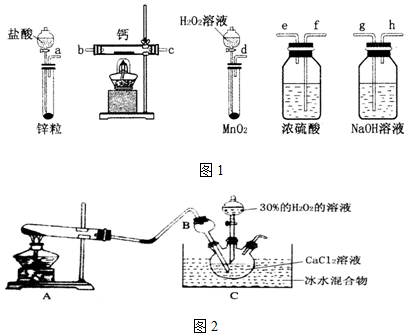
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
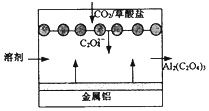
| A. | 该装置是将电能转变为化学能 | |
| B. | 正极的电极反应为:C2O42--2e-=2CO2 | |
| C. | 每得到1 mol草酸铝,电路中转移3 mol电子 | |
| D. | 利用该技术可捕捉大气中的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 用铜电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2 Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com