
将0.l mol·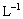 醋酸溶液加水稀释,下列说法正确的是
醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(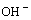 )都减小 B.溶液中c(H+)增大
)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
科目:高中化学 来源: 题型:
化学与社会、生活密切相关。对下列现象或事实解释错误的是
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 铝离子水解产生的胶体具有很强吸附杂质的作用 |
| B | SO2能使品红溶液褪色 | SO2具有漂白性 |
| C | “地沟油”禁止食用,但可以用来制肥皂 | “地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
| D | 用氯水和淀粉溶液鉴别食盐是否加碘 | 目前加碘食盐中含碘元素物质为KI |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN- Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应得到的氧化产物是____________(填化学式)。
(4)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意___________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应aA(g)  bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原的60%,则下列说法不正确的是
bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原的60%,则下列说法不正确的是
A.平衡向正反应方向移动了 B.物质A的转化率增大了
C.物质B的质量分数增加了 D.a >b
查看答案和解析>>
科目:高中化学 来源: 题型:
若pH=3的酸溶液和pH=11的碱溶液等体积混合后 溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
(1)②中发生反应的离子方程式是 。
(2)③中过滤后滤渣的成分是 。
(3)①③中如何用pH试纸测定溶液的pH值: 。
(4)③中pH升高的原因是: 。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol甲苯含有6NA个C-H键
B.25℃,pH =13的NaOH溶液中含有OH-的数目为 0.1NA
C.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA
D. 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
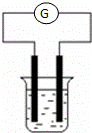
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:
| G 实验分组 | 所用金属 | 电子流向 |
| ① | A、Cu | A→Cu |
| ② | C、D | D→C |
| ③ | A、C | C→A |
| ④ | B、Cu | Cu→B |
| ⑤ | … | … |
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是 .
(2)在①中,Cu片上观察到的现象是: ;
(3)在②中,溶液中H+向金属片 移动;
(4)在④中,两金属片上均无气泡放出.此时两金属片上的电极反应式分别为:Cu: ;B: ;
(5)如果实验⑤用B、D,则导线中电流方向为: (填B→D或D→B);
(6)已知反应:Cu+2Fe3+═Cu2++2Fe2+.请用下列试剂和材料,用上图所示装置,将此反应设计成原电池并检验正极产物.
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、双氧水、NaOH溶液
材料:Cu片、Fe片、石墨棒
a、设计电池应选用的试剂和材料是: ;
b、检验正极产物选用的试剂是 ,检验反应的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com