

分析 (1)根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比分析;
(2)根据v=$\frac{△c}{△t}$计算化学反应速率;
(3)根据氢气发生氧化反应,燃料电池的负极发生氧化反应,1mol氢气反应转移2mol电子,生成1mol水,正极氧气发生还原反应;
(4)在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,电极反应为Ag++e-=Ag,应为原电池正极反应,正极材料为活泼性比Cu的金属或非金属材料,电解质溶液为含Ag+离子的溶液,如AgNO3,原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极移动,阴离子向负极移动,以形成闭合回路.
解答 解:(1)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.0mol-0.9mol):(1.0mol-0.7mol):0.2mol=1:3:2,则反应的化学方程式为3X+Y?2Z,故答案为:3X+Y?2Z;
(2)反应开始至2min,用Z表示的平均反应速率为v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05 mol.L-1.min-1,故答案为:0.05 mol.L-1.min-1;
(3)氢气发生氧化反应,燃料电池的负极发生氧化反应,1mol氢气反应转移2mol电子,生成1mol水,正极氧气发生还原反应,反应为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;2;
(4)①在Cu+2Ag+=2Ag+Cu2+反应中,Cu被氧化,应为原电池的负极,电解反应为:Cu-2e-=Cu2+,电解质溶液为含Ag+离子的溶液,如AgNO3,
故答案为:Cu;氧化;Cu-2e-=Cu2+;AgNO3溶液;
②Ag+得电子被还原生成单质Ag,正极上有银白色物质生成,电极反应为Ag++e-=Ag,应为原电池正极反应,
故答案为:碳棒上出现银白色物质;
③正极反应为Ag++e-=Ag,若导线上转移电子1mol,则生成银1mol,质量为108g,故答案为:108.
点评 本题考查物质的量随时间的变化曲线,平衡状态的判断,以及原电池的设计,题目难度不大,把握两极材料的判断以及电极反应式的书写方法为解答的关键.


科目:高中化学 来源: 题型:解答题
 X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题:
X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
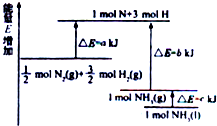 氮及其化合物与科技、生活等密切相关.
氮及其化合物与科技、生活等密切相关.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定实验中,滴定管和锥形瓶都要先洗涤、再润洗 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | 分馏时,温度计的水银球插入液面以下 | |
| D. | 除去KNO3中的NaCl杂质,可用溶解→加AgNO3溶液→过滤方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间消耗0.1 mol•L-1 A,同时消耗0.2 mol•L-1 B | |
| C. | 容器内压强不随时间变化 | |
| D. | 容器内平均相对分子质量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com