解答:
解:(1)2SO
2(气)+O
2?(气)2SO
3(气)△H<0,反应是气体体积减小的放热反应;
A.依据两种反应物增大其中一种会增大另一种的转化率,为提高SO
2的转化率,加入过量的空气,故A正确;
B.含SO
2的炉气中含有杂质气体会使催化剂中毒,含SO
2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒,和化学平衡原理无关,故B错误;
C.使用作V
2O
5催化剂加快化学反应速率,不改变化学平衡,和平衡移动原理无关,故C错误;
D.反应是放热反应,温度越低平衡正向进行,反应条件不使用很高温度和平衡移动原理有关,故D正确;
E.氧化反应在常压下进行是因为二氧化硫常压下转化率已经很大,增大压强平衡逆向进行,对转化率增大不大,不经济,故E错误;
故选AD;
(2)①由图象知,体系总压强为0.10MPa时SO
2的平衡转化率为0.8,则
2SO
2(g)+O
2(g)
2SO
3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO
2)=0.04mol/L,c(O
2)=0.02mol/L,c(SO
3)=0.16mol/L,
K=
=
=800,
故答案为:800;
②平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则k(A)=k(B),
故答案为:=;
(3)①向某密闭容器中充入1.6molSO
2和0.8molO
2,此时容器体积为100L,在温度和压强不变条件下反应达到平衡,SO
3体积分数为0.50,SO
2的转化率为α.
2SO
2(g)+O
2(g)
2SO
3(g)
起始量(mol):1.6 0.8 0
转化量(mol):1.6α 0.8α 1.6α
平衡量(mol):1.6-1.6α 0.8-0.8α 1.6α
则
×100%=0.50
α=0.6
反应平衡后气体物质的量=(1.6+0.8-0.8×0.6)mol=1.92mol
依据气体在相同条件下体积之比等于物质的量之比:(1.6+0.8)mol:100L=1.92mol:V
V=80L;
转化率α=60%
故答案为:80L;60%;
②若保持温度和压强不变,平衡时再充入1molSO
3,则平衡时SO
2体积分数=
| (1.6-1.6×0.6)mol |
| (1.6+0.8-0.8×0.6)mol |
×100%=
;
故答案为:
;
③起始时加入amolS0
2、b mol O
2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,与上述平衡状态相同,为等效平衡,物质的转化率和百分含量都相同,SO
3的体积分数为与①相同,
2SO
2+O
2 ?2SO
3起始:amol bmol 0
转化:0.6a 0.3a 0.6a
平衡:a-0.6a b-0.3a 0.6a
压强之比就等于物质的量之比,列式为:
=
,a=2b,
解得:a=2.4mol,b=1.2mol,
若起始时充入x mol SO
2、y molO
2和z mol SO
3,在,反应达平衡时,测得混合气体的体积为120L,SO
3体积分数仍为0.5,说明反应达到相同平衡状态,x=2y,X+Z=2.4,Y+
Z=1.2
故答案为:x=2y;X+Z=2.4;
④在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO
2和0.8molO
2到达平衡时,反应过程是压强减小的反应,和恒温恒压容器中比较,恒温恒压容器中压强大于恒温恒容容器中,压强增大,平衡正向进行,二氧化硫转化率增大,所以在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO
2和0.8molO
2到达平衡时,SO
2的转化率小于α;
故答案为:小于;
(4)硫酸铵溶液中铵根离子水解显酸性,溶液中离子浓度大小为:c(NH
4+)>c(SO
42-)>c(H
+)>c(OH
-),故答案为:c(NH
4+)>c(SO
42-)>c(H
+)>c(OH
-).

 (1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.



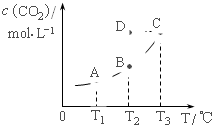 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图.下列说法错误的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图.下列说法错误的是( )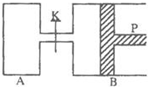 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.