
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| C. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- | |
| D. | 该消毒液中通入SO2气体可以增强漂白效果 |
分析 A.反应生成氯化钠、次氯酸钠和水;
B.消毒液与洁厕灵混合,发生氧化还原反应生成氯气;
C.白醋生成HClO,发生强酸制取弱酸的反应;
D.氯气与二氧化硫发生氧化还原反应生成硫酸和氯化氢,降低了漂白效果.
解答 解:A.反应生成氯化钠、次氯酸钠和水,用NaOH溶液吸收Cl2制备的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.消毒液与洁厕灵混合,发生氧化还原反应生成氯气,离子反应为2H++Cl-+ClO-=Cl2↑+H2O,故B正确;
C.白醋生成HClO,发生强酸制取弱酸的反应,离子反应为CH3COOH+ClO-=HClO+CH3COO-,故B正确;
D.若消毒液中通入SO2气体,氯气与二氧化硫发生氧化还原反应,减弱了漂白效果,故D错误;
故选D.
点评 本题考查离子反应方程式书写的判断,为高频考点,题目难度中等,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,综合性较强,注意离子反应中保留化学式的物质及电子、电荷守恒.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
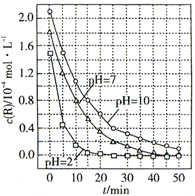
| A. | 溶液酸性越强,R的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和pH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10时R的平均降解速率为0.02 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 将苯滴入溴水中,振荡后水层接近无色 | |
| D. | 甲烷与氯气混合,光照后黄绿色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
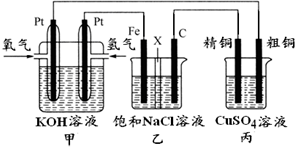
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.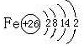 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
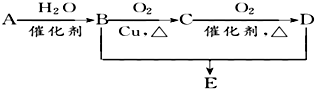 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )| A. | 由B、D制备E常用浓H2SO4作脱水剂 | |
| B. | D、E都能与NaOH溶液反应 | |
| C. | E、D、B三种物质可以用饱和Na2CO3溶液鉴别 | |
| D. | 75%的B溶液常用于医疗消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com