
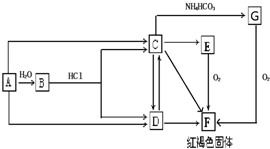
分析 A为常见金属,系列转化得到红褐色固体F为Fe(OH)3,所以A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,G为FeCO3,加热分解可以得到氧化铁,据此解答.
解答 解:A为常见金属,系列转化得到红褐色固体F为Fe(OH)3,所以A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,G为FeCO3.
(1)C的化学式为FeCl2,B为Fe3O4,俗称为 磁性氧化铁,
故答案为:FeCl2; 磁性氧化铁;
(2)A→B的化学反应方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ,
故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ;
(3)由E→F的实验现象为:白色沉淀迅速变为灰绿色最终变为红褐色,
故答案为:白色沉淀迅速变为灰绿色最终变为红褐色;
(4)FeCl2与等物质的量的过氧化钠反应可生成Fe(OH)3,其离子反应方程式为:4Na2O2+6H2O+4Fe2+═4Fe(OH)3↓+8Na++O2↑,
故答案为:4Na2O2+6H2O+4Fe2+═4Fe(OH)3↓+8Na++O2↑;
(5)已知G为FeCO3,C→G的离子反应方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
点评 本题考查无机物的推断,注意物质的颜色为推断的突破口,熟悉铁及其化合物的性质即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部是金属元素 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 同一主族元素的原子序数的差不可能为10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| D. | 氯化亚铁溶液中通入氯气:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )
A、B、C三个电解槽,如图所示A中为CuCl2溶液,B、C中均为AgNO3溶液(其中电极的大小、形状、间距均相同),B、C中浓度和体积相同,当通电一段时间后,如若A中铜电极的质量增加1.28g时,B中电极上银增加的质量为( )| A. | 4.32 g | B. | 2.16 g | C. | 1.08 g | D. | 0.54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:
神州宇宙飞行器中,每个宇航员平均每天需要消耗0.9kgO2,呼出1.0kgCO2,为保持飞船内空气的成分稳定,科学家进行了大量的科学探索,有的科学家根据电化原理设计了飞船内空气更新实验系统,该系统结构示意如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题:
A、B、C、D、E、F六种元素为前四周期元素,原子序数依次增大.A的最高正价和最低负价的绝对值相等,B的基态原子的电子分布在3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子在同周期元素中未成对电子数最多.请回答下列问题: ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com