
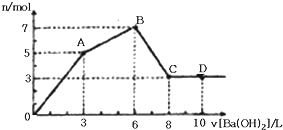
| A、OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═3BaSO4↓+2AlO2-+4H2O |
| B、向D点溶液中通入C02气体,立即产生白色沉淀 |
| C、原混合液中c[Al2(SO4)3]:c(AlCl3)═1:2 |
| D、图中C点铝元素存在形式是AlO2- |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定不含有CO2 |
| B、只含有SO2和CO |
| C、含有SO2、CO和CO2,可能含HCl |
| D、含HCl、SO2和CO,可能含CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Y |
| 12 |
| A、-Y kJ?mol-1 |
| B、-(10X-Y) kJ?mol-1 |
| C、-(5X-0.5Y) kJ?mol-1 |
| D、+(10X-Y) kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某微粒空间构型为直线形,则该微粒一定是非极性分子 |
| B、某微粒空间构型为V形,则中心原子一定是sp3杂化 |
| C、某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| D、某微粒空间构型为正四面体,则键角一定是109°28’ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸钠中含有少量的氯化钠:加水配成热饱和溶液,然后冷却结晶后过滤得到硝酸钠晶体 |
| B、氧化钙固体中混有的少量的碳酸钙,用加热分解法方法除去碳酸钙 |
| C、焰色反应实验中铂丝蘸取待测物之前先用稀硫酸洗净 |
| D、配置一定物质的量浓度溶液时,容量瓶中液面离标线1-2cm处时改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4molA+2molB |
| B、2mol A+1mol B+3mol C+1mol D |
| C、3mol C+1mol D+1mol B |
| D、3mol C+1mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、2:1 |
| C、1:2 | D、3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com