
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y<Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
分析 短周期元素R、X、Y、Z原子序数依次增大,R的气态氢化物的水溶液呈碱性,则R是氮元素;X是同周期中原子半径最大的元素,在第IA族,由于X的原子序数大于N,所以X是Na元素,Y的单质是一种常见的半导体材料是硅单质,即Y为Si元素,Y与Z的原子序数相差3,Z是Cl元素,由此分析解答.
解答 解:短周期元素R、X、Y、Z原子序数依次增大,R的气态氢化物的水溶液呈碱性,则R是氮元素;X是同周期中原子半径最大的元素,在第IA族,由于X的原子序数大于N,所以X是Na元素,Y的单质是一种常见的半导体材料是硅单质,即Y为Si元素,Y与Z的原子序数相差3,Z是Cl元素
A、Z、R、Y的最外层电子数分别为:7、5、4,所以最外层电子数:Z>R>Y,故A正确;
B、非金属性越强氢化物越稳定,非金属性Cl>Si,所以气态氢化物的稳定性:Y<Z,故B正确;
C、R为N元素,氮的氧化物是共价化合物,故C错误;
D、X最高价氧化物对应的水化物是氢氧化钠而Y最高价氧化物对应的水化物硅酸,可以发生酸碱中和反应,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,侧重于位置结构性质关系的考查,题目难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用.


科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 | |
| D. | 在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH2O与D2O的混合物中所含中子数为NA | |
| B. | 标准状况下1.4 g乙烯所含共用电子对数为0.25NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 | |
| D. | 50ml 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
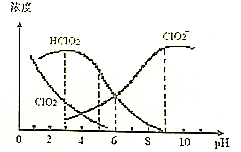
| A. | 向亚氯酸钠溶液加水稀释,溶液中n(ClO2)增大 | |
| B. | HClO2的电离平衡常数Ka=1.0×10-6 | |
| C. | NaClO2溶液中:c(Na+)+c(H+)>c(ClO2-)+c(Cl-) | |
| D. | pH=5时含氯元素的微粒浓度大小关系为:c(HClO2)>c(ClO2-)>c(Cl-)>c(ClO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
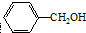 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
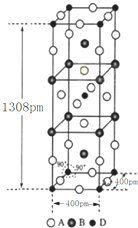 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: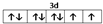 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用分液的方法分离食盐水和汽油的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com