
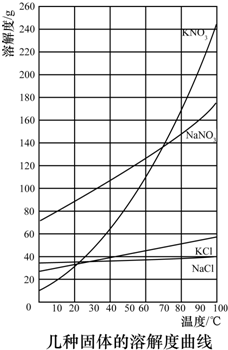
| 2 |
| 3 |
| 53.5g/mol×0.002607mol |
| 1.564g |


科目:高中化学 来源: 题型:
| A、氢氧化铝可作胃酸过多的中和剂 |
| B、福尔马林可作食品的保鲜剂 |
| C、用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| D、煎炸食物的花生油、牛油都属于可皂化的饱和酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 一定条件 |


查看答案和解析>>
科目:高中化学 来源: 题型:
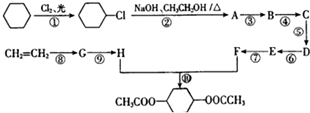
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
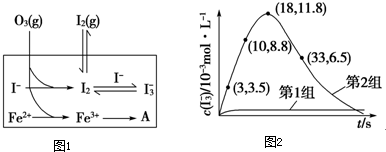
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
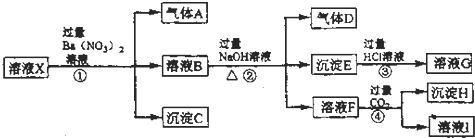
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com