
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
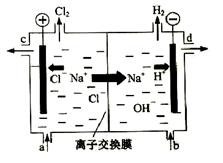
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式 。
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
【答案】(1) 2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)阻 止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)a;d;
(4)2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O.
(5)大于;SO32–>CO32–>HCO3–>HSO3–。
【解析】
(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应。产生Cl2。反应的离子方程式是2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)图中的离子交换膜只允许阳离子通,是阳离子交换膜,可以允许阳离子通过,不能使阴离子通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与氯气发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。
(4)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂C lO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O.
lO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O.
(5)NaClO、Na2SO3都是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,当最终达到平衡时,溶液中c(OH-)>c(H+),所以溶液显碱性。形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7;HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH: NaClO> Na2SO3。由于电离程度:H2SO3> H2CO3>HSO3->HCO3-,浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3- > HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为SO32–>CO32–>HCO3–>HSO3–。
【考点定位】考查电解原理的应用、氧化还原反应方程式的书写、电离平衡常数在比较离子浓度大小的应用的知识。
【名师点睛】氧化还原反应、电解原理、弱电解质的电离平衡理论、盐的水解、离子浓度大小比较是中学化学中的重要知识和理论,要掌握其反应原理、规律、方法、比较依据,再结合实际情况,进行正确的判断,得到相应的答案。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
甲醛,乙醛,丙醛组成的混和物中,氢元素占质量百分组成为9%,则混和物中氧元素占质量百分组成为
A. 37% B. 16% C. 6.6% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。
 (1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。若需规定起始时反应向逆方向进行,则c的取值范围是 。
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。若需规定起始时反应向逆方向进行,则c的取值范围是 。
⑵尿素CO(NH2)2是一种高效化肥,也是一种化工原料。密闭容器中以等物质的量NH3和CO2为原料,在1200C催化剂作用下反应生成尿素:
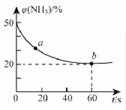
2NH3(g) + CO2(g)  CO(NH2)2 (s)+H2O(g)。混合气体中NH3的物质的量百分含量φ(NH3)随时间变化关系如右图所示。
CO(NH2)2 (s)+H2O(g)。混合气体中NH3的物质的量百分含量φ(NH3)随时间变化关系如右图所示。
则a点的正反应速率v正(CO2) b点的逆反应速率v逆(CO2)(填>、<或=); 氨气的平衡转化率是 。
⑶NH3催化氧化可得到的NO、NO2会污染环境。用间接电化学法除去NO的过程,如下图所示:
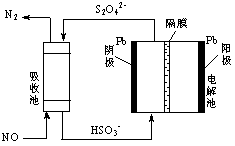
已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式: 。
用离子方程式表示吸收池中除去NO的原理: 。
⑷NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;
恰好反应后,使溶液中的CO2完全逸出,所得溶呈弱碱性,则溶液中离子浓度大小关系是c(Na+)> 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 A.用石墨作阳极,铁作阴极
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ +  5Cl-+ H2O
5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
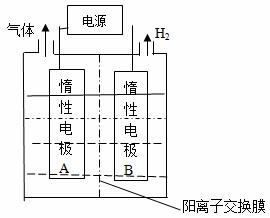
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
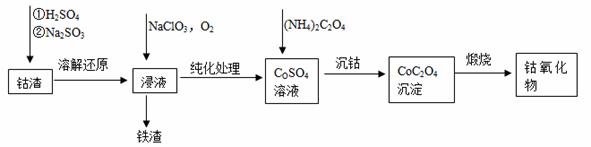
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不能产生乙酸的是----------( )
A、乙醛催化氧化 B、乙酸钠与盐酸作用
C、乙酸乙酯在酸性条件下水解 D、乙酸乙酯在碱性条件下水解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各醇能发生消去反应生成不饱和化合物的是------------------------------------------( )
A.CH3OH B.C2H5OH
C.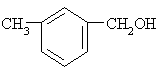 D.
D.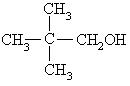
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com