
| A. | 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 | |
| B. | 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 | |
| C. | BaSO4难溶于水和强酸,在医学上常用作钡餐 | |
| D. | 食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
分析 A.二氧化硫、二氧化氮是形成酸雨的主要物质;为减少酸雨的产生,只要减少二氧化硫、氮氧化物就可以防止酸雨的产生;
B.铜锈是碱式碳酸铜,和硝酸反应不是氧化还原反应;
C.X射线对BaSO4穿透能力较差,BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒;
D.硅胶具有吸水性,铁粉具有还原性;
解答 解:A.采用燃料脱硫技术可以减少二氧化硫的产生,从而防止出现酸雨,NOx的催化转化生成无污染的氮气也是减少酸雨的有效措施,故A正确;
B.铜锈是碱式碳酸铜,利用稀硝酸清除铜镜表面的铜锈是利用了硝酸的酸性,故B错误;
C.X射线对BaSO4穿透能力较差,BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒,所以常用BaSO4做内服造影剂,故C正确;
D.硅胶具有吸水性,铁粉具有还原性,所以食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质,故D正确;
故选B.
点评 本题考查了物质性质、物质应用,注意化学知识的积累和分析判断,掌握基础是解题关键,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.6mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6mol•L-1•s-1 | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的物质的量为 1.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 饱和硫酸镁溶液 | C. | 饱和氯化钡溶液 | D. | 饱和硫酸铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | pM2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| D. | 神舟10号飞船所用太阳能电池板的材料是单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
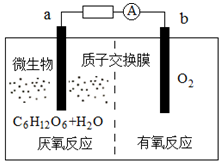 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
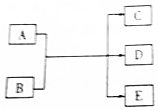 一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,B为化合物,常温下E为无色液体. ,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.
,所含化学键类型为离子键、共价键,A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使KI淀粉溶液显蓝色,则D与KI溶液反应的离子方程式是2H++2I-+ClO-=Cl-+H2O+I2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com