
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 向稀盐酸溶液中加入铁粉:2Fe+6 H+![]() 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
C. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ ![]() Cu2+ + 2 Fe2+
Cu2+ + 2 Fe2+
D. 向氯化亚铁溶液中通入氯气:Fe2+ +Cl2=Fe3+ +2Cl-
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg(OH-) 变化的关系如图所示。下列叙述错误的是

下列叙述错误的是
A. Kb1(N2H4)=10-6
B. 反应N2H62++N2H4=2N2H5+的PK=9.0 (已知:pK=-1gK)
C. N2H5C1溶液中c(H+)>c(OH-)
D. N2H5C1溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O的混合溶液浸取锌焙砂生成[Zn(NH3)4]2+的过程中加入H2O2的目的是________。
(2)加入(NH4)2S除杂过程中的主要离子方程式为________。
(3)过滤3所得滤液可循环使用,其主要成分的化学式是_______。
(4)检验2Zn(OH)2·ZnCO3沉淀是否洗涤干净的方法是________。
(5)写出沉锌步骤中发生反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
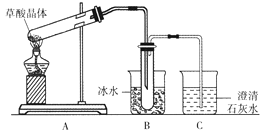
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
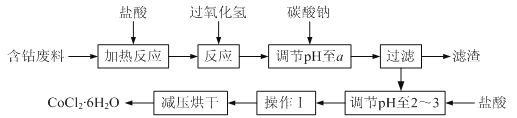
已知:①CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,易失去结晶水变成有毒的无水氯化钴。(乙醚:无色液体,沸点34.5℃,在水中的溶解度小)
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)钴的性质与铁相似,能与盐酸和硝酸反应,写出钴与盐酸反应的化学方程式:________________________________。
(2)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点:
①为__________________________,防止大气污染;
②防止产品中混有硝酸盐。
(3) 加入碳酸钠调节pH至a,a的范围应是5.2~_________。
(4) 操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和_________。
(5)根据表中数据,判断Ksp[Fe(OH)3] ________Ksp[Co(OH)2] (填“<”、“=”或“>”) 。在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是:将产品溶于乙醚过滤后,再蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组为探究金属腐蚀的相关原理,设计了如图a所示的装置,图a的铁棒末端分别连上一块Zn片和Cu片,并置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图b所示)发生了变化.已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).则下列说法不正确的是( )

A. 甲区发生的电极反应式为Fe-2e═Fe2+ B. 乙区产生Zn2+
C. 丙区呈红色 D. 丁区呈蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是

A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两只烧杯中各盛有100 Ml 2.5 mol·L-1的盐酸和NaOH溶液,向两只烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体的体积比为V(甲):V(乙)=5:6,则加入铝粉的质量为
A. 10.8g B. 3.6g C. 5.4g D. 2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol/L盐酸0.14L恰好完全反应,所得溶液还能吸收标准状况下2.24L氯气,使其中Fe2+全部转化为Fe3+.该样品可能的化学式是( )
A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com