
【题目】按要求填空
Ⅰ乳酸的工业生产可以采用生物发酵法,也可以采用有机合成法,其中的一种方法是丙酸法

(1)葡萄糖的结构简式为__________,检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a.溴水 b.银氨溶液 c.碘酒 d.碘化钾淀粉溶液
(2)丙酸合成法

①反应I的反应类型是___________,进行反应Ⅱ时,需要加入过量乙醇,这样做的目的是________。
②乳酸分子中有一个手性碳原子,通过两种反应可以使A中的手性碳原子失去手性。写出反应的化学方程式_____________________
Ⅱ“皂化值”是使1g 油脂皂化所需要的KOH的毫克数。某单甘油酯的皂化值数为190,通过计算可判断该油脂的名称为____________。
【答案】  C 取代 提高乳酸的转化率 CH3CH(OH)COOH
C 取代 提高乳酸的转化率 CH3CH(OH)COOH![]() CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2
CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2![]() 2H3COCOOH+2H2O 油酸甘油酯
2H3COCOOH+2H2O 油酸甘油酯
【解析】Ⅰ、(1)葡萄糖的结构简式为CH2OH—CHOH—CHOH—CHOH—CHOH—CHO,淀粉若完全水解,溶液中没有淀粉剩余,加入碘酒,溶液不变蓝,故选c,故答案为: CH2OH—CHOH—CHOH—CHOH—CHOH—CHO;c;
(2)①根据流程图,反应I为丙酸烃基上的取代反应;乳酸溶于乙醇,使平衡向生成乳酸的方向移动,可以提高乳酸的转化率,故答案为:取代反应;提高乳酸的转化率;
②乳酸分子中有一个手性碳原子(![]() ),通过消去反应或氧化反应可以使乳酸中的手性碳原子失去手性,反应的化学方程式分别为CH3CH(OH)COOH
),通过消去反应或氧化反应可以使乳酸中的手性碳原子失去手性,反应的化学方程式分别为CH3CH(OH)COOH![]() CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2
CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2![]() 2H3COCOOH+2H2O,故答案为:CH3CH(OH)COOH
2H3COCOOH+2H2O,故答案为:CH3CH(OH)COOH![]() CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2
CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2![]() 2H3COCOOH+2H2O;
2H3COCOOH+2H2O;
Ⅱ、设此单甘油酯的结构简式为 ,水解时,1mol酯耗3mol KOH
,水解时,1mol酯耗3mol KOH
即: ~ 3 KOH
~ 3 KOH
(3r+173)g 3×56000mg
1g 190mg
![]() =
=![]() ,解得:r=237,因此R为-C17H33,因此该单甘油酯为油酸甘油酯,故答案为: 油酸甘油酯。
,解得:r=237,因此R为-C17H33,因此该单甘油酯为油酸甘油酯,故答案为: 油酸甘油酯。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在S2、Fe2+、Fe3+、Mg2+、S、I、H+中,只有氧化性的是____________,只有还原性的是____________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是____________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______________。
①2FeCl3+2KI![]() 2FeCl2+2KCl+I2
2FeCl2+2KCl+I2
②2FeCl2+Cl2![]() 2FeCl3
2FeCl3
③2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl与I共存,为了氧化I而Cl不被氧化,除单质外,还应用上述反应中的__________作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一小块金属钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是( )
①变成白色粉末 ②变暗 ③变成白色固体 ④表面有液体生成
A. ①②③④B. ②③④①C. ②③①④D. ③②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤见下图。
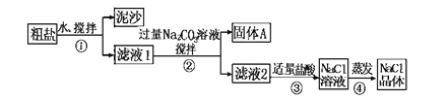
请回答:
(1)步骤①和②的操作相同,其名称是________________。
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止__________________,当蒸发皿中有较多量固体出现时,应__________________,用余热使水分蒸干。
(3)猜想和验证,补充完整相应的操作、现象和结论:
猜想 | 验证的操作 | 现象 | 结论 |
猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入_________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _________ |
猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,_________ | _________ | 猜想Ⅱ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl

实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+
H2O![]() Na2CO3+2HClO)
Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。

A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块铁片放入500mL1mol/L CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,则反应后溶液中CuSO4的物质的量浓度是(反应前后溶液的体积不变)
A. 0.9mol/L B. 0.85mol/L C. 0.8mol/L D. 0.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是

A. B极区电解液为LiOH溶液
B. 每产生标准状况下2.24L氢气,就有01 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com