
下列是一种对甘蔗渣进行废物利用的设想:
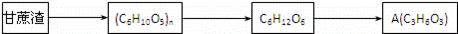
(1)已知A能与NaHCO3溶液反应产生气泡,1molA和足量的金属钠反应产生22.4L(标准状况下)H2,则A分子中含有的含氧官能团的名称是 .
(2)以A为原料可以制取一种常见树脂M:
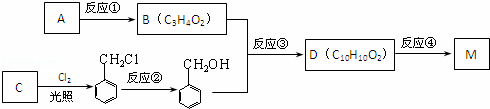
①C、M的结构简式分别为:C M ;
②反应①的反应类型为 ;
③反应②所加的试剂是 ;
④反应③的化学反应方程式为 ;
⑤D有多种同分异构体,其中有一类符合下列条件:
(a)苯环上有2个取代基且处于对位
(b)能使FeCl3溶液显色
(c)能发生银镜反应
请写出符合上述条件的一种有机物的结构简式: 等.
考点: 有机物的合成.
专题: 有机物的化学性质及推断.
分析: 甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,葡萄糖发生反应生成A,A能与NaHCO3溶液反应产生气泡,1molA和足量的金属钠反应产生22.4L(标准状况下)H2,则A分子中含有的2个能与钠反应的官能团,又A的分子式为:C3H6O3,不饱和度为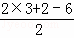 =1,所以A为HOCH2CH2COOH,A发生反应①生成B,根据B的分子式,则反应①为醇的消去反应,所以B为CH2=CHCOOH,再根据C与氯气光照生成
=1,所以A为HOCH2CH2COOH,A发生反应①生成B,根据B的分子式,则反应①为醇的消去反应,所以B为CH2=CHCOOH,再根据C与氯气光照生成 ,则C为
,则C为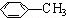 ;根据流程反应③为CH2=CHCOOH与
;根据流程反应③为CH2=CHCOOH与 发生酯化反应生成D,则D为
发生酯化反应生成D,则D为 ,D发生加聚反应生成高分子M为
,D发生加聚反应生成高分子M为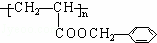 ,据此分析解答;
,据此分析解答;
解答: 解:甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,葡萄糖发生反应生成A,A能与NaHCO3溶液反应产生气泡,1molA和足量的金属钠反应产生22.4L(标准状况下)H2,则A分子中含有的2个能与钠反应的官能团,又A的分子式为:C3H6O3,不饱和度为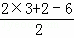 =1,所以A为HOCH2CH2COOH,A发生反应①生成B,根据B的分子式,则反应①为醇的消去反应,所以B为CH2=CHCOOH,再根据C与氯气光照生成
=1,所以A为HOCH2CH2COOH,A发生反应①生成B,根据B的分子式,则反应①为醇的消去反应,所以B为CH2=CHCOOH,再根据C与氯气光照生成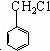 ,则C为
,则C为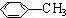 ;根据流程反应③为CH2=CHCOOH与
;根据流程反应③为CH2=CHCOOH与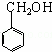 发生酯化反应生成D,则D为
发生酯化反应生成D,则D为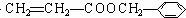 ,D发生加聚反应生成高分子M为
,D发生加聚反应生成高分子M为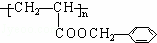 ,
,
(1)根据以上分析,A为HOCH2CH2COOH,所以所含官能团为羟基、羧基,故答案为:羟基、羧基;
(2)①根据以上分析,C结构简式为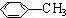 ,M结构简式为
,M结构简式为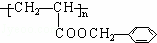 ,故答案为:
,故答案为: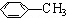 ;
;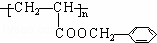 ;
;
②反应①为醇的消去反应,故答案为:消去反应;
③反应②为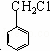 生成
生成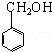 ,即为氯代烃在氢氧化钠水溶液中发生的水解反应,所以反应②所加的试剂是NaOH溶液,故答案为:NaOH溶液;
,即为氯代烃在氢氧化钠水溶液中发生的水解反应,所以反应②所加的试剂是NaOH溶液,故答案为:NaOH溶液;
④反应③为CH2=CHCOOH与 发生酯化反应,反应方程式为
发生酯化反应,反应方程式为 ,故答案为:
,故答案为: ;
;
⑤D为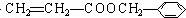 有多种同分异构体,(a)苯环上有2个取代基且处于对位
有多种同分异构体,(a)苯环上有2个取代基且处于对位
(b)能使FeCl3溶液显色,说明含有酚羟基;(c)能发生银镜反应,说明含有醛基,所以符合条件的同分异构体为: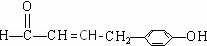 或
或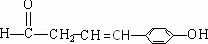 或
或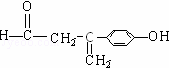 等,
等,
故答案为: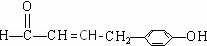 或
或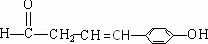 或
或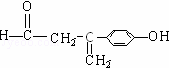 等.
等.
点评: 本题考查有机物的推断,为高频考点,侧重学生的分析能力的考查,题目难度不大,本题注意D为解答该题的关键,根据乙醇的性质进行推断,易错点为同分异构体的判断,注意不要漏写.


科目:高中化学 来源: 题型:
在2NO2⇌N2O4的可逆反应中,下列状态属于平衡状态的是( )
|
| A. | υ正=υ逆≠0时的状态 | B. | NO2全部转变成N2O4的状态 |
|
| C. | c(NO2)=c(N2O4)的状态 | D. | N2O4不再分解的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空:

(1)A的结构简式是 ,名称是 ;
(2)填写以下反应的反应类型:① ;② ;③ ;
(3)反应④的反应试剂及反应条件 ;
(4)反应②的化学方程式为 ;B水解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各选项所描述的两个量中,前者一定大于后者的是()
A. pH=3的盐酸的Cl﹣浓度和pH=3的醋酸溶液的CH3COO﹣浓度
B. pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+)
C. 0.1mol/L的盐酸和0.1mol/L的醋酸分别与金属镁反应的速率
D. pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是

A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:
 >Fe3+>I2;还原性:
>Fe3+>I2;还原性: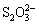 >I-;
>I-;
3I2+6OH-
 +5I-+3H2O;
+5I-+3H2O;
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是___________________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为___________________________、______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:__________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。
(2)B与氢氧化钠溶液反应的化学方程式为: 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为 ,当生成2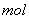 二氧化氯时,转移电子
二氧化氯时,转移电子 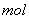 。
。
(4)溶液F在空气中长期放置生成H的化学反应方程式为: 。
(5)H的溶液与稀硫酸反应产生的现象为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W
Z+W
(1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。

①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ______________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是______________________________________
____________________________________________________________________。
反应的离子方程式是____________________________________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。

①温度在T1~T2之间,反应的化学方程式是_________________________。
②温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com