
| A、常温下,14g C2H4含有nA个氢原子 |
| B、1mol C和足量浓硫酸完全反应转移4nA个电子 |
| C、1L 0.1mol?L-1的Na2CO3溶液含有0.1nA个CO32- |
| D、标准状况下,22.4L CH3CH2OH含有个nA个CH3CH2OH分子 |
| 14g |
| 28g/mol |


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
A、比例模型为: 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |||
B、2CH3CH2OD+O2
| |||
| C、二氧化硫、氨、煤的液化均为物理变化 | |||
D、实验室中制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5
|
查看答案和解析>>
科目:高中化学 来源: 题型:
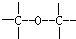 ④
④
查看答案和解析>>
科目:高中化学 来源: 题型:
 关于反应3H2(g)+N2(g)?2NH3(g)发生过程中的能量变化如图,
关于反应3H2(g)+N2(g)?2NH3(g)发生过程中的能量变化如图,| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,反应速率增大,化学平衡常数增大 |
| D、降低反应体系温度,反应速率减慢,H2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、某二元弱酸的酸式盐NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| C、NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) |
| D、常温下,将50mL0.1 mol?L-1的盐酸与100mL0.1 mol?L-1的氨水混合,所得溶液中:c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、Cd |
| B、NiO(OH) |
| C、Cd(OH)2 |
| D、Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )
NOx是汽车尾气中的主要污染物之一.通过NOx传感器可监测NOx的含量,其工作原理示意图如下.下列说法正确的是( )| A、Pt电极作负极,NiO电极作正极 |
| B、Pt电极上发生的是氧化反应 |
| C、NiO电极上发生的是还原反应 |
| D、NiO电极的电极反应式为NO+O2--2e-═NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
.现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com