
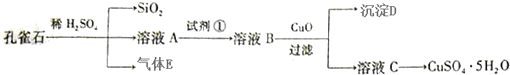
分析 (1)(2)(3)孔雀石用稀硫酸溶液,发生反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O、FeO+H2SO4=FeSO4+H2O,气体E为CO2,溶液A中含有CuSO4、FeSO4及未反应的H2SO4,溶液C可以得到硫酸铜晶体,则溶液A中加入氧化剂将Fe2+氧化为Fe3+,再用CuO调节溶液pH,使Fe3+转化为Fe(OH)3沉淀过滤除去,为防止引入新杂化,试剂①为H2O2.溶液C经过加热浓缩、冷却结晶、过滤、洗涤等得到硫酸铜晶体;
(4)溶液中c(Fe3+)=10-5mol/L时,溶液中的Fe3+沉淀完全,根据Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=1×10-38计算溶液中c(OH-),再结合Kw计算溶液中c(H+),根据pH=-lgc(H+)计算;
(5)开始电池总反应式为:2CuSO4+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$2Cu+O2↑+2H2SO4,相当于析出CuO,铜离子放电完毕,电池反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,Cu(OH)2改写为CuO•H2O,则析出Cu为0.2mol,生成氢气为0.2mol,进而计算转移电子,根据Cu原子守恒计算硫酸铜溶液物质的量浓度.
解答 解:孔雀石用稀硫酸溶液,发生反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O、FeO+H2SO4=FeSO4+H2O,气体E为CO2,溶液A中含有CuSO4、FeSO4及未反应的H2SO4,溶液C可以得到硫酸铜晶体,则溶液A中加入氧化剂将Fe2+氧化为Fe3+,再用CuO调节溶液pH,使Fe3+转化为Fe(OH)3沉淀过滤除去,为防止引入新杂化,试剂①为H2O2.溶液C经过加热浓缩、冷却结晶、过滤、洗涤等得到硫酸铜晶体.
(1)由上述分析可知,试剂①是将Fe2+氧化为Fe3+,且不能引入杂杂质,最佳试剂为过氧化氢,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:a;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)溶液B中加入CuO作用是:调节pH值,使Fe3+完全转化为Fe(OH)3沉淀,
故答案为:调节pH值,使Fe3+完全转化为Fe(OH)3沉淀;
(3)由溶液C获得CuSO4•5H2O晶体,需要经 蒸发浓缩、冷却结晶和过滤等操作,
故答案为:蒸发浓缩、冷却结晶;
(4)溶液中c(Fe3+)=10-5mol/L时,溶液中的Fe3+沉淀完全,根据Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=1×10-38,可知溶液中c(OH-)=10-11mol/L,则c(H+)=10-3mol/L,此时溶液pH=-lg10-3=3,故必需调节溶液pH>3,
故答案为:3;
(5)开始电池总反应式为:2CuSO4+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$2Cu+O2↑+2H2SO4,相当于析出CuO,铜离子放电完毕,电池反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,若加入0.2mol Cu(OH)2恰好使电解液恢复到原来状态,Cu(OH)2改写为CuO•H2O,则析出Cu为0.2mol,生成氢气为0.2mol,转移电子为0.2mol×2+0.2mol×2=0.8mol,根据Cu原子守恒,可知硫酸铜为0.2mol,则原硫酸铜溶液物质的量浓度为$\frac{0.2mol}{0.5L}$=0.4mol/L,
故答案为:0.8;0.4.
点评 本题考查物质制备工艺流程、溶度积有关计算、电解原理计算等,掌握物质分离提纯方法,(5)中关键是明确发生的反应,较好的考查学生分析计算能力,难度中等.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀 | |
| B. | 操作②、操作③分别是过滤与蒸发结晶 | |
| C. | 反应①加料之前需将反应器加热至100℃以上并通入氩气 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | 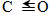 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA | |
| B. | 0.1molZn与含0.1molHCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 铝粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
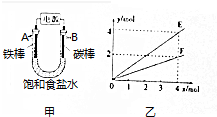
| A. | E表示反应生成NaOH的物质的量 | B. | E表示反应消耗H2O的物质的量 | ||
| C. | F表示反应生成H2或Cl2的物质的量 | D. | F表示反应消耗NaCl的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com