铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比KMnO4更强,本身在反应中被还原为Fe3+生成Fe(OH)3,达到净水目的,它是由Fe(NO3)3,NaOH和Cl2在一定条件下制得:
2Fe(NO3)3+16NaOH+3Cl2→□Na2FeO4+□NaNO3+□______+□H2O
(1)在横线上填上适当的物质,使制备Na2FeO4反应原理完整,并用双线桥法表示出点子转移的方向和数目______.
(2)反应使用的Fe(NO3)3可以用Fe粉和稀HNO3反应制(提示:反应过程中HNO3只被还原成NO),现在要制备Na2FeO483g的问:需要Fe粉______克,HNO3______克?
【答案】
分析:(1)由质量守恒定律及电子守恒来配平化学反应,Fe元素的化合价由+3价升高为+6价,Cl元素的化合价应为0降低为-1价,以此来解答;
(2)由Fe+4HNO
3=Fe(NO
3)
3+NO↑+2H
2O及Fe~Fe(NO
3)
3~Na
2FeO
4来计算.
解答:解:(1)Fe元素的化合价由+3价升高为+6价,Cl元素的化合价应为0降低为-1价,由质量守恒定律及电子守恒可知配平后化学反应为
2Fe(NO
3)
3+16NaOH+3Cl
2=2Na
2FeO
4+6NaNO
3+6NaCl+8H
2O,用双线桥法表示出点子转移的方向和数目为
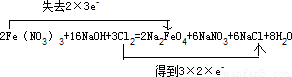
,
故答案为:6NaCl;
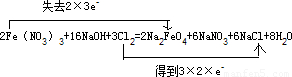
;
(2)Fe~Fe(NO
3)
3~Na
2FeO
4可知,n(Fe)=n(Na
2FeO
4)=
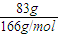
=0.5mol,则m(Fe)=0.5mol×56g/mol=28g,
由Fe+4HNO
3=Fe(NO
3)
3+NO↑+2H
2O可知,n(HNO
3)=0.5mol×4=2mol,则m(HNO
3)=2mol×63g/mol=126g,
故答案为:28;126.
点评:本题考查氧化还原反应,明确元素的化合价变化及发生的化学反应是解答本题的关键,注意利用原子守恒来进行计算,题目难度不大.

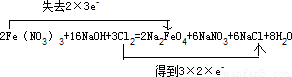 ,
,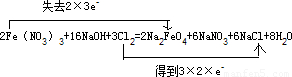 ;
;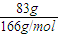 =0.5mol,则m(Fe)=0.5mol×56g/mol=28g,
=0.5mol,则m(Fe)=0.5mol×56g/mol=28g,

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案