
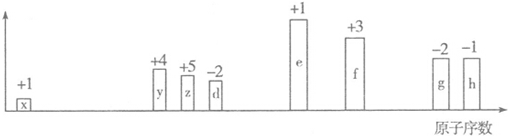
·ÖĪö £Ø1£©ŅĄ¾Ż¢ŁøßĪĀĻĀÓĆ¹żĮæµÄĢ¼»¹Ō¶žŃõ»Æ¹čÖĘµĆ“Ö¹č£¬ŹéŠ“»Æѧ·½³ĢŹ½£»
£Ø2£©øł¾ŻĢāÄæøų³öµÄŠÅĻ¢£¬ĄūÓĆ·ŠµćµÄ²»Ķ¬Ģį“æSiHCl3ŹōÓŚÕōĮó£»
£Ø3£©ĒāĘųŹĒæÉČ¼ŠŌĘųĢ壬ŅײśÉś±¬ÕØ£¬ĪŖ·ĄÖ¹°²Č«ŹĀ¹ŹµÄ·¢Éś£¬ĖłŅŌĻČĶØŅ»¶ĪŹ±¼äH2£¬½«×°ÖĆÖŠµÄæÕĘųÅž”£»
£Ø4£©¹čŹĒŅ»ÖÖĮ¼ŗƵİėµ¼Ģå²ÄĮĻ£®
½ā“š ½ā£ŗ£Ø1£©øßĪĀĻĀ£¬ÓĆ¹żĮæµÄĢ¼»¹Ō¶žŃõ»Æ¹čÖĘµĆ“Ö¹č£¬Ģ¼×ö»¹Ō¼ĮŹ±Éś³ÉCO£¬¼“»Æѧ·½³ĢŹ½ĪŖ£ŗ2C+SiO2$\frac{\underline{\;øßĪĀ\;}}{\;}$2CO+Si£»
¹Ź“š°øĪŖ£ŗ2C+SiO2$\frac{\underline{\;øßĪĀ\;}}{\;}$2CO+Si£»
£Ø2£©µĆµ½µÄSiHCl3£Ø·Šµć33.0”ę£©ÖŠŗ¬ÓŠÉŁĮæSiCl4£Ø·Šµć57.6”ę£©ŗĶHCl£Ø·Šµć-84.7”ę£©£¬·ŠµćµÄ²»Ķ¬Ģį“æSiHCl3æɲÉÓĆÕōĮó·½·Ø£»ÕōĮóµÄŅĒĘ÷ŠčŅŖµÄÓŠ£ŗÕōĮóÉÕĘ攢ĪĀ¶Č¼Ę”¢ĄäÄż¹Ü”¢×¶ŠĪĘ森
¹Ź“š°øĪŖ£ŗÕōĮó£»ÕōĮóÉÕĘ攢ĪĀ¶Č¼Ę”¢ĄäÄż¹Ü”¢×¶ŠĪĘ棻
£Ø3£©ĒāĘųŹĒæÉČ¼ŠŌĘųĢ壬µ±ĒāĘųµÄĮæ“ļµ½Ņ»¶ØŹ±ŅײśÉś±¬ÕØ£¬ĪŖ·ĄÖ¹°²Č«ŹĀ¹ŹµÄ·¢Éś£¬ĖłŅŌĻČ½«ĒāĘųøÉŌļ£¬²¢ĻČĶØŅ»¶ĪŹ±¼äH2£¬½«×°ÖĆÖŠµÄæÕĘųÅž”£¬
¹Ź“š°øĪŖ£ŗ½«ĒāĘųøÉŌļ£»ĻČĶØŅ»¶ĪŹ±¼äH2£¬½«×°ÖĆÖŠµÄæÕĘųÅž”£»
£Ø4£©¹čŹĒŅ»ÖÖĮ¼ŗƵİėµ¼Ģå²ÄĮĻ£¬æÉÓĆ×÷¹čŠ¾Ę¬”¢¹čĢ«ŃōÄܵē³Ų°å£¬¹Ź“š°øĪŖ£ŗ°ėµ¼Ģå»ņ¹čŠ¾Ę¬»ņ¹čĢ«ŃōÄܵē³Ų°å£®
µćĘĄ ±¾Ģāæ¼²éĮĖŹµŃé·½°øÉč¼ĘµÄÓŠ¹ŲÖŖŹ¶£¬ĢśĄė×ÓŗĶŃĒĢśĄė×ӵļģŃéŌŚøßæ¼ĢāÖŠ³öĻÖ£¬ÕāÖÖĄąŠĶµÄĢāŹĒøßæ¼µÄČČµć£¬ŹĒѧĻ°µÄÖŲµć£¬»įøł¾ŻŹµŃéÄæµÄŗĶĪļÖŹµÄŠŌ֏єȔŹµŃé×°ÖĆŗĶŹµŃéŅ©Ę·£¬Č»ŗó½ųŠŠĻąÓ¦µÄŹµŃ飮



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Ģ½¾æSO2µÄŠŌÖŹ£®¼××éĶ¬Ń§½«SO2·Ö±šĶØČėĻĀĮŠ3ÖÖČÜŅŗÖŠ£®
Ģ½¾æSO2µÄŠŌÖŹ£®¼××éĶ¬Ń§½«SO2·Ö±šĶØČėĻĀĮŠ3ÖÖČÜŅŗÖŠ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©”÷H1 2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H2 | |
| B£® | S£Øg£©+O2£Øg£©ØTSO2£Øg£©”÷H1 S£Øs£©+O2£Øg£©ØTSO2£Øg£©”÷H2 | |
| C£® | C£Øs£©+$\frac{1}{2}$O2£Øg£©ØTCO£Øg£©”÷H1 C£Øs£©+O2£Øg£©ØTCO2£Øg£©”÷H2 | |
| D£® | 2HCl£Øg£©ØTH2£Øg£©+Cl2£Øg£©”÷H1 $\frac{1}{2}$H2£Øg£©+$\frac{1}{2}$Cl2£Øg£©ØTHCl£Øg£©”÷H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŹµŃé | ĻÖĻó | ½įĀŪ | |
| A | ½«ĀČĘųĶØČėĘ·ŗģČÜŅŗ | ČÜŅŗŗģÉ«ĶŹČ„ | ĀČĘų¾ßÓŠĘư׊Ō |
| B | ½«Ķ·Ū¼ÓČė1.0mol•L-1 µÄFe2£ØSO4£©3ČÜŅŗÖŠ | ČÜŅŗ±äĄ¶£¬ÓŠŗŚÉ«¹ĢĢå³öĻÖ | ½šŹōFe±ČCu»īĘĆ |
| C | ÓĆŪįŪöĒƼŠ×”ÓĆɰֽ׊Ļø“ņÄ„¹żµÄĀĮ²ŌŚ¾Ę¾«µĘÉĻ¼ÓČČ | ČŪ»ÆŗóµÄŅŗĢ¬ĀĮµĪĀäĻĀĄ“ | ½šŹōĀĮµÄČŪµć±Č½ĻµĶ |
| D | ĻņŹ¢ÓŠÉŁĮæÅØĻõĖį”¢Ļ”ĻõĖįµÄĮ½Ö§ŹŌ¹ÜÖŠ·Ö±š¼ÓČėŅ»Ę¬“óŠ”ĻąĶ¬µÄĶʬ | ÅØĻõĖįÖŠĶʬŗÜæģæŖŹ¼Čܽā£¬²¢·Å³öŗģ×ŲÉ«ĘųĢ壻Ļ”ĻõĖįÖŠ¹żŅ»»įĶʬ±ķĆę²Å³öĻÖĪŽÉ«ĘųĢ壬ĘųĢåÓöæÕĘų±äŗģ×ŲÉ« | ÅØĻõĖįŃõ»ÆŠŌĒæÓŚĻ”ĻõĖį |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH4+ | B£® | Al3+ | C£® | Fe2+ | D£® | Fe3+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µ°°×ÖŹÓöÅØĻõĖį±ä»Ę | |
| B£® | ŗ¬ÄĘŌŖĖŲµÄĪļÖŹŌŚ»šŃęÉĻ×ĘÉÕ²śÉś»ĘÉ«»šŃę | |
| C£® | pHŹŌÖ½ÓėijČÜŅŗ½Ó“„±äĪŖŗģÉ« | |
| D£® | ĪŽÉ«ÅØĻõĖį¾ĆÖĆŗó±ä»Ę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
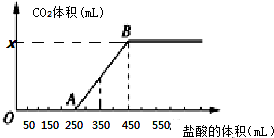
| A£® | OA¶Ī·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗH++OH-ØTH2O”” CO32-+H+ØTHCO3- | |
| B£® | µ±¼ÓČė350 mLŃĪĖįŹ±£¬²śÉśCO2µÄĢå»żĪŖ224 mL£Ø±ź×¼×“æö£© | |
| C£® | xµć¶ŌÓ¦µÄŹżÖµŹĒ448 | |
| D£® | »ģŗĻĪļÖŠNaOHµÄÖŹĮæĪŖ1æĖ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com