
【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。
【答案】三颈烧瓶 ![]() 用
用![]() 的水浴加热 吸收未反应的
的水浴加热 吸收未反应的![]() ,防止污染环境 将
,防止污染环境 将![]() 氧化为
氧化为![]()
![]() 将滤液加热并保温在
将滤液加热并保温在![]() ,用氨水调节溶液
,用氨水调节溶液![]() 并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出
并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出![]()
【解析】
由装置图结合实验步骤可知,以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,装置A制取SO2,装置B通入SO2与MnO2反应得到MnSO4,在不断搅拌下向仪器R中加入适量纯净的MnO2,将
,装置A制取SO2,装置B通入SO2与MnO2反应得到MnSO4,在不断搅拌下向仪器R中加入适量纯净的MnO2,将![]() 氧化为
氧化为![]() ,再加入MnCO3调节溶液pH,使Fe3+和Al3+形成沉淀而除去;最后加入适量
,再加入MnCO3调节溶液pH,使Fe3+和Al3+形成沉淀而除去;最后加入适量![]() 沉铅,过滤得
沉铅,过滤得![]() 溶液;装置C中盛有NaOH溶液,用来吸收未反应的
溶液;装置C中盛有NaOH溶液,用来吸收未反应的![]() ,防止污染环境。
,防止污染环境。
滤液中含有MnSO4,控制温度在![]() ,调节溶液
,调节溶液![]() 并维持8~9。用空气氧化生成的Mn(OH)2得到黑色沉淀Mn3O4,过滤,洗涤、干燥得产品
并维持8~9。用空气氧化生成的Mn(OH)2得到黑色沉淀Mn3O4,过滤,洗涤、干燥得产品![]() 。据此解答。
。据此解答。
(1)由仪器构造可知仪R的名称是三颈烧瓶,
故答案为:三颈烧瓶;
(2)装置![]() 中亚硫酸钠固体和硫酸反应生成硫酸钠、水和
中亚硫酸钠固体和硫酸反应生成硫酸钠、水和![]() ,化学方程式为
,化学方程式为![]() ,
,
故答案为:![]() ;
;
(3)由于需要控制温度在90~100℃,所以适宜的加热方式是用![]() 的水浴加热,
的水浴加热,
故答案为:用![]() 的水浴加热;
的水浴加热;
(4) 装置C中盛有NaOH溶液,用来吸收未反应的![]() ,防止污染环境,
,防止污染环境,
故答案为:吸收未反应的![]() ,防止污染环境;
,防止污染环境;
(5)除杂过程中加入纯净![]() 的目的是将
的目的是将![]() 氧化为
氧化为![]() ;用
;用![]() 调节溶液
调节溶液![]() 时,使Fe3+、Al3+沉淀完全,而Mn2+不沉淀,需调节溶液
时,使Fe3+、Al3+沉淀完全,而Mn2+不沉淀,需调节溶液![]() 的范围为
的范围为![]() ,
,
故答案为:将![]() 氧化为
氧化为![]() ;
;![]() ;
;
(6)由图象可知,应选择的反应条件是:温度![]() ,溶液pH为8~9;实验方案设计为:将滤液加热并保温在
,溶液pH为8~9;实验方案设计为:将滤液加热并保温在![]() ,用氨水调节溶液
,用氨水调节溶液![]() 并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出
并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出![]() ,
,
故答案为:将滤液加热并保温在![]() ,用氨水调节溶液
,用氨水调节溶液![]() 并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出
并维持8~9。在不断搅拌下,边通空气边滴加氨水,直至有大量黑色沉淀,静置,在上层清液中再滴加氨水至无沉淀。过滤,洗涤沉淀直至过滤液中检测不出![]() 。
。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:

下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用O2氧化HCl转化成Cl2,提高效益,减少污染。反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。一定条件下,测得数据如下:
2Cl2(g)+2H2O(g)。一定条件下,测得数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
c(Cl2)/10-3molL-1 | 0 | 1.8 | 3.7 | 5.4 | 7.2 | 7.2 |
下列说法错误的是( )
A.条件不变时,12min时v正(Cl2)=v逆(H2O)
B.2.0~4.0min内的平均反应速率大于6.0~8.0min内的
C.0~8.0min内HCl的平均反应速率为1.8mol·L-1·min-1
D.加入高效催化剂,达到平衡所用时间小于8.0min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
CO2(g) + NO(g)ΔH=-234 kJ/mol该反应的平衡常数为K1(下同)
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________;
以及此热化学方程式的平衡常数K=________(用K1、K2、K3表示)。
(2)①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是________。
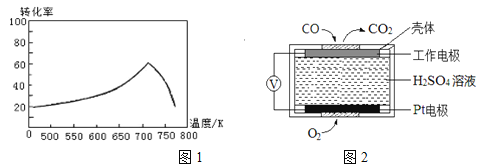
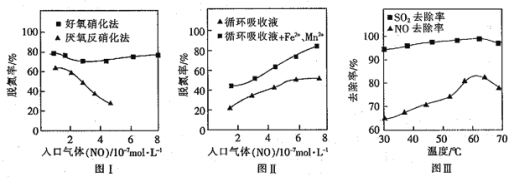
②已知:测定空气中NO和CO含量常用的方法有两种:
方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为____;
方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式:________________。
(3)NO2会污染环境,可用Na2CO3溶液吸收NO2 并生成CO2,已知9.2gNO2气体和Na2CO3溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶被呈弱碱性,则溶液中存在的所有离子浓度大小关系是____________________________。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图I、Ⅱ所示。
①由图I知,当废气中的NO含量增加时,宜选用___________法提高脱氮的效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为___________。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入1molCH3COOCH3(l)和1molC6H13OH(l)发生反应:CH3COOCH3(l)+C6H13OH(l) ![]() CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。
CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。

回答下列问题:
(1)CH3COOCH3的一种同分异构体属于酸,它的结构简式为___。
(2)己醇(C6H13OH)中,含3个甲基的结构有___种(不考虑立体异构)。
(3)M点:正反应速率___逆反应速率(填“大于”“小于”或“等于”,下同)。N点正反应速率___M点逆反应速率。
(4)上述反应在0~5min内CH3COOCH3的平均反应速率为___mol·min-1。
(5)上述反应达到平衡时,C6H13OH的转化率为___%。
(6)N点混合物中CH3COOC6H13的物质的量分数为___%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:

(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成
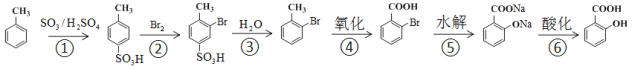
①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
③以烃A为原料,合成聚甲基丙烯酸的路线如下:
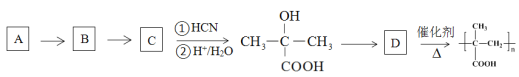
已知:
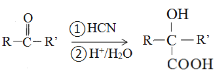
(R、R’为烃基或氢原子)
请填写有机物A~D的结构简式,在所有箭头上标注试剂和条件_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和砷均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为________。同一周期As、Ge、Se三种元素的第一电离能由大到小的顺序为________________。
(2)Na3AsO3中所含阴离子的立体构型为___________,写出一个与AsO33-具有相同空间构型和键合形式的分子____________________(填化学式)。
(3)在一定条件下NH3与CO2能合成尿素[CO(NH2)2],尿素中C原子和N原子轨道的杂化类型分别为__________,_________;1mol尿素分子中,![]() 键的数目为___________。
键的数目为___________。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是__________________。
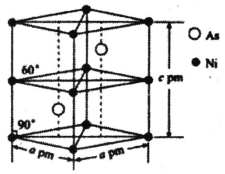
(5)某砷镍合金的晶胞结构如图所示,阿伏加德罗常数的值为NA,则该晶体的密度![]() =________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
=________g·cm-3,该晶体中与每个Ni原子距离最近的As原子有_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com