
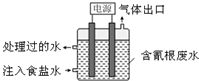
 某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒.图所示装置是工业上采用的电解法除去含CN-废水的装置.工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )
某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒.图所示装置是工业上采用的电解法除去含CN-废水的装置.工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )| A. | 用石墨作阴极,铁作阳极 | |
| B. | 阴极的电极反应式为:2H2O+2e-=H2↑+2OH- | |
| C. | 阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 除去CN-的反应:2CN-+5ClO-+H2O=N2↑+2CO2↑+5Cl-+2OH- |
分析 A.电解时,用不活泼金属或导电非金属作阳极;
B.阴极上水失电子生成氢气和氢氧根离子;
C.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应在碱性条件下进行,所以应该有氢氧根离子生成.
解答 解:A.电解时,阳极产生的ClO-,则不活泼金属或导电非金属作阳极,所以可以用石墨作阳极、铁作阴极,故A错误;
B.电解质溶液呈碱性,则阴极上水失电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,故B正确;
C.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故C正确;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故D正确;
故选A.
点评 本题考查了电解原理的应用,题目难度中等,注意把握电解池中电极的判断方法和电解方程式的书写方法,侧重于考查学生的分析能力和对基础知识的应用能力.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
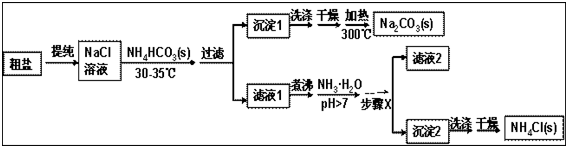
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+H2O═H2SO3 | B. | H2CO3═CO2↑+H2O | ||
| C. | 2NaOH+H2SO4═Na2SO4+2H2O | D. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体制备:向沸水中逐滴加入少量饱和硫酸铁溶液,继续加热煮沸至液体变为红褐色,停止加热 | |
| B. | 用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 中和热实验,在操作时应将碱液分多次倒入酸中,以防液体溅出,产生误差 | |
| D. | 萃取碘水中的碘实验时,将碘水倒入分液漏斗,然后再注入乙醇,振荡、静置分层后,下层紫色液体先从下口放出,之后,上层无色液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 | |
| B. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为8NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com