
【题目】向含Fe(NO3)3、Cu(NO3)2、HNO3的某种稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。下列说法错误的是( )
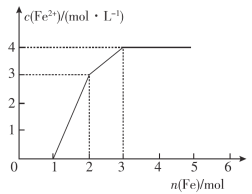
A.横轴0~1:Fe+NO![]() +4H+==Fe3++NO↑+2H2O
+4H+==Fe3++NO↑+2H2O
B.横轴1~2:Fe+2Fe3+=3Fe2+
C.横轴2~3:Fe+Cu2+=Fe2++Cu
D.原溶液中三种溶质浓度相等
【答案】D
【解析】
根据氧化性:HNO3>Fe3+>Cu2+,Fe先与氧化性强的物质反应,即Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,然后是:Fe+2Fe3+=3Fe2+,最后阶段Fe+Cu2+═Fe2++Cu,由图中起点、拐点、终点的位置来确定化学反应情况。
Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液氧化性为HNO3>Fe3+>Cu2+,金属铁先和氧化性强的离子反应;
A.开始阶段是金属铁和硝酸之间的反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,当加入金属铁1mol是,生成三价铁离子是1mol,所以亚铁离子的浓度不变,故A正确;
B.金属铁和硝酸反应结束后,生成1mol的三价铁离子,然后发生反应Fe+2Fe3+=3Fe2+,此时加入的1mol铁会和三价铁反应生成3mol亚铁离子,故B正确;
C.反应的最后阶段为:Fe+Cu2+=Fe2++Cu,所有的离子均被还原,故C正确;
D.根据以上分析,整个过程的反应为:4H++NO3-+3Fe+Fe3++Cu2+=4Fe2++Cu+NO↑+2H2O,则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为1:1:4,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,16g O2含有的原子数为1 NA
C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L
D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 3mol单质Fe在纯氧中完全燃烧,失去8NA个电子
B. 1molCu和足量热浓硫酸充分反应可生成NA个SO3分子
C. 标准状况下,22.4L N2和H2的混合气体中含有NA个原子
D. 78g Na2O2中含共价键数目为2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)是一种很好的供氧剂,与稀盐酸发生反应的化学方程式为
2Na2CO4 + 4HCl = 4NaCl + 2CO2↑ + O2↑ + 2H2O市售过碳酸钠中一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋(该气袋耐酸碱腐蚀),取适量样品于其中,打开分液漏斗活塞,将足量稀盐酸滴入气袋中至充分反应。

(1)过碳酸钠的化学式也可表示为 aNa2O2· bNa2CO3,请写出Na2O2的电子式:__________________
(2)仪器B的名称为________,导管A的作用是_________________________________________
(3)该实验共需测定两个数据,首先需测定反应所生成的气体的总体积,故滴加稀盐酸前必须关闭___和___并打开____(均填“K1”、“K2”或“K3”)
(4)其次用量筒Ⅱ测定混合气体中某种成分的体积,则 B中装的固体试剂名称为_________,具体测定过程如下:当Q中反应停止后,使 K1 和 K3 处于关闭状态, K2处于打开状态,再缓缓打开K1即可。
(5)实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是_____________(用含有x、y的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是
A.摩尔是一个物理量,它表示含有一定数目粒子的集合体
B.摩尔是物质的量的单位,简称摩,符号为mol
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔
D.1摩尔任何物质均含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Cu(IO3)2+24KI+12H2SO4=2CuI![]() (碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
(碘化亚铜)+13I2+12K2SO4+12H2O,下列说法正确的是 ( )
A.Cu(IO3)2作氧化剂,Cu(IO3)2中只有碘元素被还原
B.CuI既是氧化产物又是还原产物
C.每生成1mol CuI,有11mol KI发生氧化反应
D.每转移1.1mol电子,有0.2mol IO3-被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后______(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理含氰![]() 废水可以用以下两种方法:
废水可以用以下两种方法:
Ⅰ:![]() (未配平),其中A为参与大气循环的气体
(未配平),其中A为参与大气循环的气体
Ⅱ:①![]() (未配平)
(未配平)
②![]() 下列说法正确的是( )
下列说法正确的是( )
A. ![]() 和
和![]() 的电子式分别为
的电子式分别为![]()
![]()
B. 方法Ⅰ中,每生成![]() ,转移
,转移![]() 个电子
个电子
C. 方法Ⅱ中,![]() 是反应②的氧化产物
是反应②的氧化产物
D. 方法Ⅱ的反应①中,![]() 与
与![]() 的物质的量之比为1∶1
的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
(1)基态硼原子的价电子轨道表达式是_______________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________。
(2)晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的________。
(3)B的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为________。

②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子_____(填化学式)。
(4)以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂。BH![]() 的键角是________,立体构型为___________。
的键角是________,立体构型为___________。
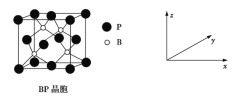
(5)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______;已知晶胞边长为458 pm,则磷化硼晶体的密度是____g·cm-3(列式并计算,结果保留两位有效数字,已知4.583=96.07)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com