
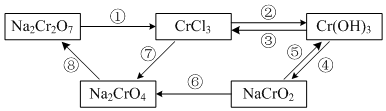
分析 (1)根据元素化合价的代数和为0计算;
(2)需要加入还原剂才能实现,说明该物质作氧化剂;Na2Cr2O7与浓盐酸反应生成氯气、氯化铬、氯化钠和水;
(3)Na2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+Na2SO4+3K2SO4+3I2+7H2O中Cr的化合价从+6降为+3价,I的化合价从-1价升高到了0价,反应中转移电子数为6;根据反应方程式结合电子转移情况来计算即可;
(4)根据物质的转化确定既能与强酸反应又能与强碱反应的两性物质,产物均是盐和水.
解答 解:(1)Na2Cr2O7中Na元素的化合价为+1价,O为-2价,则Cr元素的化合价为+6价;
故答案为:+6;
(2)需要加入还原剂才能实现,说明该物质作氧化剂,反应中该物质中元素的化合价降低,则Na2Cr2O7转化为CrCl3需要加还原剂,Na2Cr2O7与浓盐酸反应生成氯气、氯化铬、氯化钠和水,反应的化学方程式为:Na2Cr2O7+14HCl(浓)=2NaCl+2CrCl3+3Cl2↑+7H2O;
故答案为:①;Na2Cr2O7+14HCl(浓)=2NaCl+2CrCl3+3Cl2↑+7H2O;
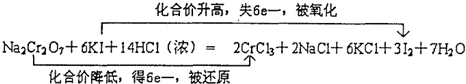
(3)Na2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+Na2SO4+3K2SO4+3I2+7H2O中Cr的化合价从+6降为+3价,I的化合价从-1价升高到了0价,可表示可表示为 ,Cr的化合价降低被还原,Cr2(SO4)3为还原产物;I的化合价从-1价升高到0价,生成1molI2转移2mol电子,则反应中每转移0.4mol电子,生成I2的物质的量为0.2mol;
,Cr的化合价降低被还原,Cr2(SO4)3为还原产物;I的化合价从-1价升高到0价,生成1molI2转移2mol电子,则反应中每转移0.4mol电子,生成I2的物质的量为0.2mol;
故答案为: ;Cr2(SO4)3;0.2mol;
;Cr2(SO4)3;0.2mol;
(4)在上述转化中,Cr(OH)3既能与强酸反应生成氯化铬,又能与强碱反应生成NaCrO2,故答案为:Cr(OH)3.
点评 本题考查氧化还原反应知识,侧重于学生的分析能力和基本概念的考查,注意从元素化合价的角度分析该类题目,题目难度中等,注意把握双线桥法表示氧化还原反应的电子转移.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁片投入足量浓H2SO4中,转移电子数目为0.3 NA | |
| B. | MnO2与浓盐酸共热,0.4 molHCl被氧化时,转移电子数目为0.4 NA | |
| C. | 高温下,0.3 molFe与足量水蒸气反应,转移电子数目为0.8NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
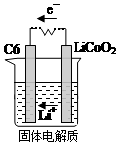 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.2 g Na2O所含的离子数为0.2 NA | |
| B. | 46 gNO2与N2O4的混合气体中所含的原子数是3NA | |
| C. | 2.8 gN2中含有共用电子对的数目为0.1 NA | |
| D. | 0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com