CO和H
2作为燃料和化工原料,有着十分广泛的应用.
(1)已知:C(s)+O
2(g)=CO
2(g)△H
1=-393.5kJ?mol
-1C(s)+H
2O(g)=CO(g)+H
2(g)△H
2=+131.3kJ?mol
-1则反应CO(g)+H
2(g)+O
2(g)=H
2O(g)+CO
2(g)的△H=
kJ?mol
-1.
标准状况下将33.6LCO、H
2的混合气体在足量氧气充分燃烧,生成CO
2和H
2O,将生成的产物通过足量的过氧化钠固体,固体增加的质量为16g,则原混合气体中CO、H
2的体积比为
.
(2)利用反应CO(g)+H
2(g)+O
2(g)=H
2O(g)+CO
2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图1所示.
则①M应是电源的
极(填“正”或“负”);
②该电解反应的离子方程式为
;
(3)一定温度下在体积为5L的密闭容器中加入2mol Fe(s)与1molH
2O(g),t
1秒时,H
2的物质的量为0.20mol,到第t
2秒时恰好达到平衡,此时H
2的物质的量为0.35mol.
①t
1~t
2这段时间内的化学反应速率V(H
2)=
.
②若继续通人1mol H
2O(g)再次达到平衡后,H
2的物质的量为
mol.
③该反应的逆反应速率随时间变化的关系如图2,t
1时改变了某种条件,改变的条件可能是
.

 CO和H2作为燃料和化工原料,有着十分广泛的应用.
CO和H2作为燃料和化工原料,有着十分广泛的应用.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案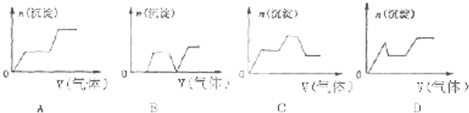
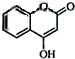 是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成: