
| A. | 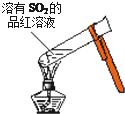 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 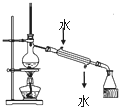 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
分析 A.二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,受热易复原;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流;
C.蒸馏时,温度计测量馏分温度,冷凝管中水应该采用“下进上出”原则;
D.用托盘天平称量药品时应该采取“左物右砝”原则,且具有腐蚀性药品应该放置在烧杯中称量.
解答 解:A.二氧化硫的漂白性不稳定,加热时易复原,所以加热二氧化硫漂白后的溶液时,溶液由无色变为红色,故A错误;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流,否则易溅出溶液导致配制溶液浓度偏低,故B正确;
C.用蒸馏法制取蒸馏水时,如果馏分急剧冷却会炸裂冷凝管,为防止炸裂冷凝管,所以冷凝管中上口为进水口、下口为出水口,故C错误;
D.用托盘天平称量药品时遵循“左物右砝”原则,且腐蚀性药品要放置在烧杯中称量,NaOH具有强腐蚀性,为防止腐蚀托盘天平,称量氢氧化钠固体时放置在烧杯中,故D错误;
故选B.
点评 本题考查化学实验方案评价,涉及基本实验操作、二氧化硫的漂白性等知识点,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验原理和操作方法,注意C中如果冷凝管竖直放置时,冷却水应该采用“下进上出”原则,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向足量AgNO3溶液中先滴加少量NaCl溶液,后滴加少量KI溶液 | 先产生白色沉淀后又产生黄色沉淀 | AgI比AgCl更难溶 |
| B | 溴乙烷和烧碱的乙醇溶液共热 | 产生的气体可使酸性高锰酸钾溶液褪色 | 证明有乙烯生成 |
| C | 将高温水蒸气通过灼热的铁粉 | 铁粉变红 | 铁与水在高温下能发生反应 |
| D | Fe粉中加入过量的稀HNO3,充分反应后滴入几滴KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/ml | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)始/ml | 0.00 | 0.20 | 0.10 | 0.10 |
| V(NaOH)终/ml | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 香草醛用作化妆品的香精和定香剂,也是食品香料和调味剂,还可做抗癫痫药.香草醛的分子结构如图,下列关于香草醛的说法中,不正确的是( )
香草醛用作化妆品的香精和定香剂,也是食品香料和调味剂,还可做抗癫痫药.香草醛的分子结构如图,下列关于香草醛的说法中,不正确的是( )| A. | 该化合物的分子式为C8H6O3 | |
| B. | 遇FeCl3溶液会显紫色 | |
| C. | 1mol该物质最多能与4molH2发生加成反应 | |
| D. | 与香草醛有相同官能团且苯环上有三个取代基的香草醛的同分异构体(包括香草醛)有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 | B. | 4 | C. | 2 | D. | 256 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 5:3 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com