
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
分析 A.氨水为弱碱,二者反应生成氢氧化铝沉淀;
B.钙离子与氢氧根离子的计量数关系错误;
C.氯气与氯化亚铁反应生成氯化铁;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.氯化铝溶液中加入过量的氨水,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.澄清石灰水与苏打溶液混合,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故B错误;
C.氯化亚铁溶液中通入氯气,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故C正确;
D.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
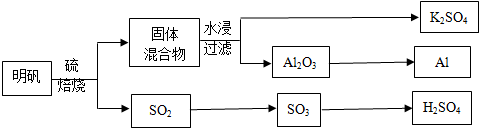

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
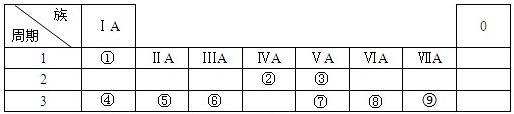
 ;元素的⑨离子结构示意图是
;元素的⑨离子结构示意图是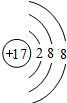 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 | ||
| C. | 二氧化氯是电解质 | D. | 二氧化氯分子中氯为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体总质量不变 | |
| B. | 反应物B的物质的量浓度不变 | |
| C. | 混合气体的平均相对分子质量不变 | |
| D. | 物质C的生成速率和D的消耗速率之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向右移动 | B. | x+y>z | C. | B的转化率提高 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CH2O2 | C. | C6H12O6 | D. | C12H22O11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3的酸性比H2CO3的酸性强,说明S的非金属性比C强 | |
| B. | 根据非金属性强弱F>Cl,可以推测沸点HF>HCl | |
| C. | 进行H2O和H2S气体的热分解实验,可确定S、O两种元素的非金属性强弱 | |
| D. | 已知2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,说明C的非金属性比Si强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有漂白性 | |
| B. | Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 | |
| C. | 用砂纸打磨过的铝箔放在酒精灯焰上不燃烧,说明铝不易与O2反应 | |
| D. | 向装有NaHCO3溶液的两支试管中各滴入CaCl2和MgCl2的饱和溶液,后者有沉淀呈现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com