
| A. | K+、Na+、AlO2-、NO3- | B. | NH4+、Al3+、NO3-、SO42- | ||
| C. | K+、NH4+、SO32-、S2- | D. | K+、Ag+、NO3-、Cl- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
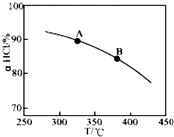 用O2将HCl转化为Cl2,可提高效益,减少污染,
用O2将HCl转化为Cl2,可提高效益,减少污染,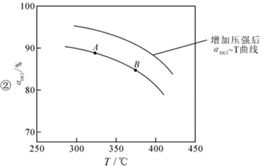 增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.
增大压强,平衡右移,ɑHCl增大,相同温度下,HCl的平衡转化率比之前实验的大.| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度(mol• L-1) | NaOH物质的 量浓度(mol• L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(1×10-8+1×10-10)mol/L | B. | (1×10-8+1×10-10)mol/L | ||
| C. | (1×10-14-5×10-5)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY4 | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b 点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氧硫酸更弱的酸 | |
| C. | 原H2S溶液的物质的量浓度为0.05mol•L-1 | |
| D. | ab段反应是:SO2+2H2S═3S↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com