
【题目】恒温下,将Xmol N2 和Ymol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3N2(g)![]() 2NH3(g)
2NH3(g)
⑴若反应进行到t时刻,n(N2)=10mol,n(NH3)=4mol,计算X的值。
⑵反应达到平衡时,混合气体的体积为672L(标准状况下),其中NH3的体积分数为20%,计算N2的转化率和Y的值。
【答案】(1)12;(2)25%;24。
【解析】
试题分析:(1)反应进行到t时,测的N2为10mol,NH3为4mol,由方程式可知,参加反应的氮气的物质的量为4mol×![]() =2mol,故氮气的起始物质的量为:10mol+2mol=12mol,即X=12,故答案为:12;
=2mol,故氮气的起始物质的量为:10mol+2mol=12mol,即X=12,故答案为:12;
(2)反应达平衡时,混合气体为![]() =30mol,其中NH3的物质的量为30mol×20%=6mol,参加反应的氮气的物质的量为6mol×
=30mol,其中NH3的物质的量为30mol×20%=6mol,参加反应的氮气的物质的量为6mol×![]() =3mol,则N2的转化率为
=3mol,则N2的转化率为![]() ×100%=25%;
×100%=25%;
N2 (g) + 3H2(g)![]() 2NH3(g),物质的量减少△n
2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化:4mol 12mol 6mol 6mol
故原混合气体为30mol+6mol=36mol,由(1)知X=12mol,
则Y=36mol-12mol=24mol,故答案为:25%;24。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】取一定质量的均匀固体混合物Cu、CuO和Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20 g,另一份中加入500 mL稀硝酸(其还原产物为NO),固体恰好完全溶解,且同时收集到标准状况下NO气体4.48 L,则所用硝酸的物质的量浓度为( )
A.2.4 mol/L B.1.4 mol/L C.1.2 mol/L D.0.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,有如下反应:2SO2(g)+O2(g)![]() 2SO3(g),将1.6molSO2和0.8mol O2放入一体积可变的密闭容器中,测得容器的起始容积为100L经一段时间后,反应达到平衡,测得混合气体的体积为80L,请回答下列问题:
2SO3(g),将1.6molSO2和0.8mol O2放入一体积可变的密闭容器中,测得容器的起始容积为100L经一段时间后,反应达到平衡,测得混合气体的体积为80L,请回答下列问题:
(1)达平衡时SO2的转化率为______________;
(2)若起始时加入amolSO2、bmol O2,且a:b=2:1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L。则a、b的值分别为:a=__________,b=__________。
(3)若容器为体积不变的密闭容器,其容积为100L,起始时加入xmolSO2、ymol O2和zmol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为___________,x、z应该满足的关系式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钫(Fr)元素在周期表中位于第七周期,第IA族,根据钫在周期表中的位置推测其性质,其中错误的 是( )
A.其单质的熔点比钠的熔点低
B.其氧化物对应的水化物的碱性很强
C.其原子半径在同一主族中是最大的
D.在空气中燃烧只能生成Fr2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
A. 1:6 B.1:7 C.2:11 D.16:25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
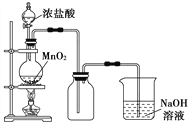
(1)圆底烧瓶中发生反应的化学反应方程式是__________________。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热(忽略盐酸的挥发),充分反应后生成的氯气明显_________(填大于、等于、小于)0.06 mol。其主要原因有_____________________________;
(3)写出尾气处理的离子方程式是_______________________。
II、用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量:____________。定容时,向容量瓶中加水,至1~2cm时,改用_________加水至刻度,加盖摇匀;
(2)下列操作对所配溶液的浓度可能产生影响
①Na2CO3·10H2O晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体(使用游码) ③碳酸钠晶体不纯,其中混有氯化钠 ④容量瓶未经干燥使用。 其中引起所配溶液浓度偏高的有______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、运用铁及其化合物的知识,完成下列各题。
(1)下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是________。
A.盐酸 B.氯气 C.CuSO4溶液 D.稀硫酸
(2)把过量的铁粉加入稀硝酸中,其结果是________。
A.不反应 B.生成硝酸铁 C.生成硝酸亚铁
(3)要除去FeCl2溶液中的少量FeCl3,可行的办法是________。
A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉
Ⅱ、工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。

(1)写出①步反应的化学方程式:____________________________________________________。
(2)下列环境问题与NO2的排放有关的是________(填字母序号)。
A.赤潮 B.光化学烟雾 C.臭氧空洞 D.温室效应 E.酸雨
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是( )
A.为人体内的化学反应提供原料
B.为维持人体生命活动提供能量
C.加强胃肠蠕动,具有通便功能
D.人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com