
���� ��1����������ǿ�����ԣ�������ɱ����������������������Ӧ��������������������ˮ�����ɾ��������Ե������������壻
��2�����ݻ������и�Ԫ�صĻ��ϼ۵Ĵ�����Ϊ0����m��
��3��������д����������ʽ���Ⱥ�˳��Ϊ�����ý���������ϻ��ý���������������衢ˮ���Դ˽��
��� �⣺��1��������ˮ��Ӧ���ɾ���ǿ�����Ե�HClO��������ɱ����������������������Ӧ��������������������ˮ�����ɾ��������Ե������������壬������ˮ�������������γɳ�����ʹˮ������
�ʴ�Ϊ��Cl2��ˮ��Ӧ����HClO��HClO��ɱ��ˮ��ϸ�����������ã�Cl2�ܽ�Fe2+ ������Fe3+��Fe3+ˮ�����ɵ�Fe��OH��3������к�ǿ������������������ˮ�������������γɳ�����ʹˮ������
��2���ڻ�����[Al2��OH��nClm•yH2O]X��Al��+3�ۣ�OH-��-1�ۣ�H2O��0�ۣ�Cl��-1�ۣ�����
2����+3��+n����-1��+m����-1��+y��0=0
����m=6-n��
�ʴ�Ϊ��6-n��
��3��������д����������ʽ���Ⱥ�˳��Ϊ�����ý���������ϻ��ý���������������衢ˮ��������ʯ�Ļ�ѧ��������������ʽ�ɱ�ʾΪ��Na2O•3FeO•Fe2O3•8SiO2•H2O��
�ʴ�Ϊ��Na2O•3FeO•Fe2O3•8SiO2•H2O��
���� ���⿼��Ԫ�ػ������������Ӧ�ã�Ϊ��Ƶ���㣬�����ڻ�ѧ������Ŀ��飬����������ѧ�����õĿ�ѧ���������ѧϰ�Ļ����ԣ�ע�⣺������д����������ʽ���Ⱥ�˳��Ϊ�����ý���������ϻ��ý���������������衢ˮ����ʯ�������ᡢ���ᷴӦ���Ĺ�ϵΪ����ѵ㣬����������ʵ������ǽ��ؼ�����Ŀ�Ѷ��еȣ�


 Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
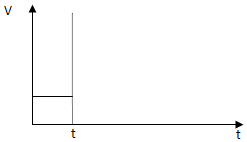 ��һ��������ܱ������У����з�Ӧ��CO2��g��+H2��g��?CO��g��+H2O��g�����䷴Ӧ��ѧƽ�ⳣ����T�Ĺ�ϵ�����ʾ��
��һ��������ܱ������У����з�Ӧ��CO2��g��+H2��g��?CO��g��+H2O��g�����䷴Ӧ��ѧƽ�ⳣ����T�Ĺ�ϵ�����ʾ��| T/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2P2��g���TP4��g����H=-229.7 kJ•mol-1 | B�� | P2��P4�Ƿ��ȷ�Ӧ | ||
| C�� | P2��P4�����ȶ� | D�� | ������ʱ��P2��P4���е������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| Ͷ�ϱ�[n��NO2��/n��CH4��] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
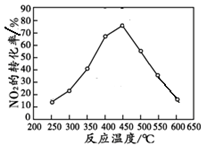
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪2H2��g��+O2��g���T2H2O��g����H=-483.6 kJ/mol����������ȼ����Ϊ241.8 kJ/mol | |
| B�� | ��֪NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H=-57.3 kJ/mol����0.5 mol NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�������С��28.65kJ | |
| C�� | ��ȼ���ϵ��Ϊ1��ȼ�շ�Ӧ���ʱ伴Ϊ�ÿ�ȼ���ȼ���� | |
| D�� | ��֪2C��s��+2O2��g���T2CO2��g����H=a kJ/mol��2C��s��+O2��g���T2CO��g����H=b kJ/mol����a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ȼ����Ϊ��H=-890kJ•mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890 kJ?mol-1 | |
| B�� | 500�桢30 MPa�£���0.5 mol N2��1.5 mol H2�����ܱյ������г�ַ�Ӧ����NH3��g��������19.3 kJ�����Ȼ�ѧ����ʽΪN2��g��+3H2��g��?2NH3��g����H=-38.6 kJ•mol-1 | |
| C�� | ��֪��H2��g��+F2��g��=2HF��g������H=-270 kJ/mol����1 mol������1 mol������Ӧ����2 molҺ̬������ų�������С��270 KJ | |
| D�� | ��C����ͬ�����£�2 mol HF���������С��1 mol������1 mol�����������ܺ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
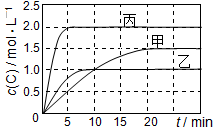 ��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A��g��+xB��g��?2C��g�����������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����������ͼ��ʾ��
��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A��g��+xB��g��?2C��g�����������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����������ͼ��ʾ��| ���� | �� | �� | �� |
| �ݻ� | 0.5 L | 0.5 L | 1.0 L |
| �¶�/�� | T1 | T2 | T2 |
| ��Ӧ�� ��ʼ�� | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A�� | ƽ�������������ٳ���0.5 mol A��A��B��ת���ʾ����� | |
| B�� | �ﵽƽ��ʱ��Ӧ���յ�������Q����2Q�� | |
| C�� | ��ƽ��ʱ�����¶Ȳ��䣬�ı��������ƽ�ⲻ�ƶ� | |
| D�� | T1�棬��ʼʱ�������г���0.5 mol A��1.5 mol B��ƽ��ʱA��ת����Ϊ25% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com